
科目: 来源: 题型:
Ⅰ(10分) A、B、C、D四种元素在周期表中分别处于元素X的四周(如下图),已知X元素最高价氧化物的化学式为X2O5,且五种元素中有一种元素的原子半径是它们所处的同族中最小的。试确定:
(1)各元素的符号:
A:_____,B:____,C:____,D:_____,X:_____。
(2)写出C、D、X最高价氧化物对应水化物的化学式,并排列酸性由强到弱的顺序:___________。
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:__________________。
Ⅱ(8分)Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+![]() 2Fe2++I2(水溶液),
2Fe2++I2(水溶液),
⑴该反应的平衡常数K的表达式为:K= ___________________________
[物质的浓度用“c(物质)”表示]。当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡________移动(填“向右”、“向左”、“不”)。
⑵上述反应的正向反应速率和I-、Fe3+的浓度关系为:v=K[c(I-)]m[c(Fe3+)]n(其中K为常数)
| c(I-)(mol/L) | c(Fe3+)(mol/L) | v[mol/(L?s)] | |
| ⑴ | 0.20 | 0.80 | 0.032K |
| ⑵ | 0.60 | 0.40 | 0.144K |
| ⑶ | 0.80 | 0.20 | 0.128K |
通过所给的数据计算得知:
①在v=K[c(I-)]m[c(Fe3+)]n中,m、n的值为_________。
A. m=1、n=1 B. m=1、n=2 C. m=2、n=1 D. m=2、n=2
②I-浓度对反应速率的影响_______Fe3+浓度对反应速率的影响(填“>”、“<”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
Ⅰ⑴玻璃棒是中学化学实验中常用的仪器。下列过程中,一般不需要玻璃棒的是 ( 填写编号 )
①用PH试纸测定Na2CO3溶液的PH
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2?8H2O晶体和NH4Cl晶体反应过程中的能量变化。
⑤实验室用新制备的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
⑵用“大于”“等于”“小于”填空
① 读量筒中液体的体积时,视线偏高,读取的体积数 实际体积数
② 用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称食盐的质
量 10.4g
③配制500ml 0.1mol/lNaOH溶液,定容时俯视刻度线,所得溶液的物质的量浓
度 0.1mol/l
④用中和滴定法测某NaOH溶液的浓度,量取待测液未用该溶液润洗滴定管,测得的溶液的浓度 实际浓度
Ⅱ、氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:![]()
![]()
![]() 、
、![]() 、
、![]() 、
、![]()
![]() 四种物质中的一种物质能使上述还原过程发生。
四种物质中的一种物质能使上述还原过程发生。
(1)写出该氧化还原反应的方程式(不配平): 。
(2)该反应中氧化剂和还原剂物质的量之比为 。
(3)反应中硝酸体现了 、 性质。
(4)反应中若产生0.1mol气体,则转移电子的物质的量是 。
| B | ||
| A | X | C |
| D |
查看答案和解析>>
科目: 来源: 题型:
已知298K时, N2(g)+3H2(g)=2 NH3(g);△H=-92.4kJ/mol, 在相同条件下,向密闭容器中加入1molN2和3molH2,达到平衡时放出的热量为Q1,向另一容积相同的密闭容器中通入0.95molN2、2.85molH2和0.1molNH3,达到平衡时放出的热量为Q2,则下列关系式正确的是
A.Q1 = Q2 = 92.4kJ B.Q2 < Q1 = 92.4kJ
C.Q2< Q1< 92.4kJ D..Q2 = Q1 < 92.4kJ
查看答案和解析>>
科目: 来源: 题型:
向含有0.2 mol氢氧化钠和0.1 mol氢氧化钙的溶液中,持续稳定地通入二氧化碳气体,通入气体为6.72 L(标准状况)时,立即停止,则这一过程中,溶液中离子数目与通入二氧化碳气体体积的关系正确的是(不考虑气体的溶解) C
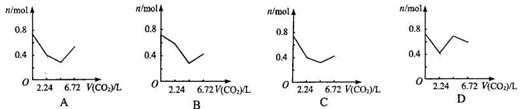
查看答案和解析>>
科目: 来源: 题型:
在一定条件下,使CO和O2的混合气体26g充分反应,所得混合物在常温下跟足量的Na2O2固体反应,结果固体增重14g,则原混合气体中O2和CO的质量比可能是
A.9:4 B.1:1 C.7:6 D.6:7
查看答案和解析>>
科目: 来源: 题型:
0.1mol/L的CH3COONa溶液和0.1mol/L的盐酸等体积混合后,溶液中离子浓度关系符合实际的是
A.c(![]() )>c(CH3COOH)
)>c(CH3COOH)
B.c(![]() )+c(
)+c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
C.c(![]() )+c(
)+c(![]() )>c(
)>c(![]() )
)
D.c(![]() )+c(CH3COOH)=c(
)+c(CH3COOH)=c(![]() )
)
查看答案和解析>>
科目: 来源: 题型:
已知:4NH3(g)+5O2(g)=4NO(g)+6H2O(g). △H= -1025KJ/mol该反应是一个可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是 C
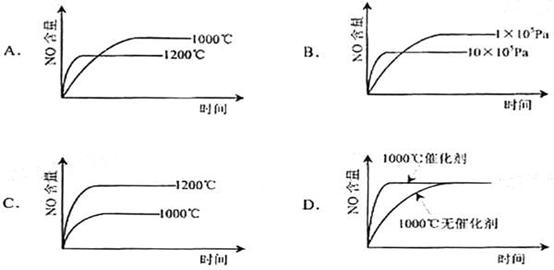
查看答案和解析>>
科目: 来源: 题型:
某温度下,在固定容积的容器中,可逆反应:A(g)+3B(g)![]() 2C(g)达到平衡,测得平衡时物质的量之比为2:2:1,保持温度、体积不变,再以2:2:1的体积比将A、B、C充入此容器中,则
2C(g)达到平衡,测得平衡时物质的量之比为2:2:1,保持温度、体积不变,再以2:2:1的体积比将A、B、C充入此容器中,则
A. 平衡向逆反应方向移动 B. 平衡不移动
C. C的百分含量增大 D. B的浓度减小
查看答案和解析>>
科目: 来源: 题型:
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O===3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A.放电时负极反应为:3Zn ―6e―+6OH― == 3Zn(OH)2
B.放电时正极反应为:2FeO42―+6e―+8H2O===2Fe(OH)3+10OH―
C.放电时每转移3mol电子,正极有1mol K2FeO4被还原
D.放电时正极附近溶液的碱性减弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com