
科目: 来源: 题型:
电解质量分数为23.4%的精制食盐水1000 g,电解后残液的密度为1.20 g/mL。将产生的H2、Cl2在一定条件下反应制成质量分数为36.5%的盐酸180 g,已知H2、Cl2的利用率均为90%。计算:
(1)制得氯化氢__________mol;
(2)残液中氯化钠的质量为_____________ g;
(3)残液中氢氧化钠的物质的量浓度___________mol/L(保留两位小数)。
查看答案和解析>>
科目: 来源: 题型:
现有一包混有Na2CO3的食盐,欲测定其纯度,取5.000 g这种食盐,加入足量的盐酸后逸出112 mL CO2气体(标准状况下)。
(1)5.000 g这种食盐中Na2CO3的质量是多少克?
(2)求这包食盐的纯度。
查看答案和解析>>
科目: 来源: 题型:
某食盐样品中混有NaBr杂质,为了测定该食盐样品的纯度,设计的实验过程如下图所示:
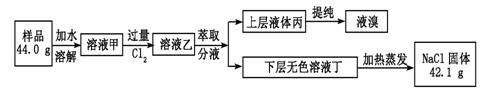
阅读上述实验过程,完成下列填空:
(1)写出溶液甲与氯气气反应的化学方程式 。
(2)萃取和分液时,所使用的玻璃仪器有 、 。
(3)依据题图所示,在萃取操作中应选取的萃取剂为___________
A.四氯化碳 B.苯 C.乙醇 D.蒸馏水
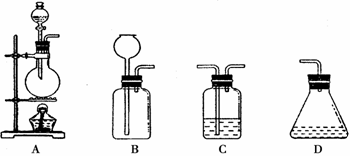
(4)请你从上图中选出必要的装置(可重复使用)来完成向溶液甲中通入过量Cl2的实验,将所选装置的选项字母填入字框,并在括号中写出装置内的所放的化学药品。
→ | C | → | → |
( ) (饱和食盐水) (溶液甲) ( )
(5)试计算原固体混合物中氯化钠的质量分数为__________________。
查看答案和解析>>
科目: 来源: 题型:
在肉制品加工中,使用的护色剂――亚硝酸钠(NaNO2)必须严格控制用量,以确保食用安全。已知:2 NaNO2 + 4HI → 2NO↑ + 2H2O + 2NaI + I2
(1)标出电子转移的方向和数目:
2 NaNO2 + 4HI → 2NO↑ + 2H2O + 2NaI + I2
(2)该反应中的氧化剂是 。
(3)发生氧化反应的物质是 。
(4)若有1mol电子转移,则氧化产物的物质的量是 mol 。
(5)若误食亚硝酸钠会导致血红蛋白中亚铁离子转化为铁离子而中毒,服用维生素C可解除亚硝酸钠的中毒,下列关于上述中毒、解毒过程的说法中,正确的是
A.亚硝酸钠是还原剂 B.维生素C是氧化剂
C.维生素C能把铁离子还原成为亚铁离子 D.亚硝酸钠被还原
查看答案和解析>>
科目: 来源: 题型:
根据下面的流程回答问题:
![]()
(1)上图的流程中,电解饱和食盐水的化学方程式是 ,如果用得到的溶液吸收某种生成的气体,得到一种具有消毒杀菌作用的物质,反应的化学方程式是 。高考资源网
(2)在工业上,将电解饱和食盐水得到的气体通入合成塔中合成氯化氢,其中需要过量的气体是 ,在合成塔中燃烧时火焰呈 色。
(3)实验室常用MnO2和浓盐酸在加热条件下制取氯气,反应的化学方程式是:
。
(4)用氯气可制取漂粉精。在日常生活中使用漂粉精时,反应原理是(用化学方程式表示) 。
查看答案和解析>>
科目: 来源: 题型:
由FeSO4和Fe2(SO4) 3组成的混合物,测得该混合物中硫元素的质量分数为a%,则铁元素的质量分数为
A.a% B.2a% C.3a% D.1-3a%
查看答案和解析>>
科目: 来源: 题型:
向KI溶液中加入AgNO3溶液,直到刚好完全反应为止,所得溶液的质量恰好等于原碘化钾溶液的质量,则AgNO3溶液的质量百分比浓度是
A.27.7% B.72.3% C.70.6% D.29.4%
查看答案和解析>>
科目: 来源: 题型:
4个同学同时分析一个由KCl和KBr组成的混合物,他们各取2.00克样品配成水溶液,加入足量的HNO3酸化的AgNO3溶液,待沉淀完全后过滤、洗涤、干燥,得到的卤化银沉淀的质量如下列四个选项所示,其中数据肯定错误的是
A.3.36g B.3.56g C.3.76 g D.3.96 g
查看答案和解析>>
科目: 来源: 题型:
下列各微粒都具有与氖原子相同电子层结构的是
A.O2-、F- 、N3― B.Na+、Ca2+、Al3+
C.Na+ 、K+ 、S2- D.Cl- 、S2- 、K+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com