
科目: 来源: 题型:
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=1g![]() 。则下列叙述不正确的是 ( )
。则下列叙述不正确的是 ( )
A.中性溶液的AG=0
B.碱性溶液的AG>0
C.AG越小碱性越强,酸性越弱
D.常温下0.1mol?L-1氢氧化钠溶液的AG=-12
查看答案和解析>>
科目: 来源: 题型:
常温下列各种溶液中,可能大量共存的离子组是 ( )
A.pH=0的溶液中:Fe2+、NO3-、SO42-、I-
B.由水电离出的c(OH-)=1×10-13mol?L-1的溶液中:Na+、AlO2-、S2-、CO32-
C.含有大量Fe3+的溶液中:Na+、I-、K+、NO3-
D.c(H+)=10-14mol?L-1的溶液中:Mg2+、NO3-、Fe2+、ClO-
查看答案和解析>>
科目: 来源: 题型:
常温下,关于溶液的稀释说法正确的是 ( )
A.将1 L 0.1mol?L-1的Ba(OH)2溶液加水稀释为2L,pH=13
B.pH=3的醋酸溶液加水稀释100倍,pH=5
C.pH=4的H2SO4加水稀释100倍,溶液中由水电离产生的[H+]=1×10-6mol?L-1
D.pH=8的NaOH溶液加水稀释100倍,其pH=6
查看答案和解析>>
科目: 来源: 题型:
右图是恒温下某反应的化学反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是 ( )
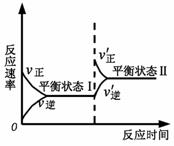
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目: 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。则下列说法正确的是 ( )
A.电池工作时,MnO2发生还原反应
B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH-
C.电池工作时,K+移向负极
D.电池工作时,电路中每通过0.1mol电子,锌的质量理论上减少6.5g
查看答案和解析>>
科目: 来源: 题型:
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH。下列说法不正确的是( )
A.浓度均为0.1mol?L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1mol?L-1CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中含有Na+、F-、H+、OH-、H2O、HF六种微粒
D.NaF溶液中加入少量NaOH固体,溶液中[F-]变大
查看答案和解析>>
科目: 来源: 题型:
已知31g红磷(P,固体)在氧气中燃烧生成P4O10固体放出738.5kJ热量,31g白磷(P4,固体)在氧气中燃烧生成P4O10固体放出745.8kJ热量。下列判断正确的是 ( )
A.白磷在氧气中燃烧的热化学方程式是:
P4(s)+5O2(g)=P4O10(s) ΔH=-745.8kJ?mol-1
B.红磷转化成白磷时放出热量
C.红磷比白磷稳定
D.31g红磷中蕴含的能量为738.5kJ
查看答案和解析>>
科目: 来源: 题型:
将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应
NO2(g)+CO(g)![]() CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是 ( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中的CO2的体积分数是 ( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目: 来源: 题型:
已知镁粉与冷水几乎不反应,与热水反应缓慢。市场上购买的“即热饭盒”底部有两层,一层装水,另一层是镁粉与铁粉的混合物,当水与金属粉末接触时会发生反应Mg+2H2O=Mg(OH)2+H2↑。则下列说法不正确的是 ( )
A.“即热饭盒”的工作原理是将化学能转化为热能
B.上述反应中,反应物的总焓大于生成物的总焓
C.铁粉的作用是催化剂
D.上述反应的反应热Q为正值
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com