
科目: 来源: 题型:
(08上海卢湾区期末)高铁(Ⅵ)酸盐是新一代水处理剂,其制备方法有:①次氯酸盐氧化法(湿法);②高温过氧化物法(干法)等。
(1)①法在碱性溶液中,利用次氯酸盐氧化三价铁盐,配平下列化学方程式:
____Fe3+ +___ClO- + ___OH- → ___FeO42- + Cl- + ___H2O
其中当1mol还原剂发生反应时________(填“得到”或“失去”)_____mol电子。
(2)②法是Na2O2/FeSO4体系在N2流中于700℃反应1小时,可得到高铁酸盐,其中作氧化剂的是______。
(3 (3)高铁酸盐作为水处理剂比氯源型净水剂(如漂白剂等)具有的优越性是_________。
查看答案和解析>>
科目: 来源: 题型:
(08上海建平中学期末)把H2S通入碘水中,过滤出生成的硫,可得一定浓度的氢碘酸,氢碘酸可被空气中的O2氧化为I2。I2在水溶液中易与红磷反应生成PI3,并水解生成HI和H3PO3(亚磷酸)
(1)写出氢碘酸氧化变质的离子方程式,并标出电子转移的方向与数目:
(2) (填“能”或“不能”)用浓硫酸与固体NaI共热制HI,原因是:
。
(3)在配制的氢碘酸溶液中,可加入少量的红磷。当该溶液置于空气中时,只要溶液的体积不变,则所配制HI溶液的物质的量浓度不会变化。其原因是(用化学方程式表示):
查看答案和解析>>
科目: 来源: 题型:
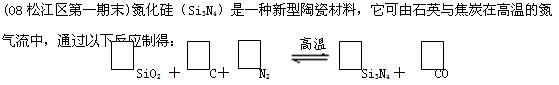
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应在标准状况下产生11.2升CO气体,则电子转移数为 摩尔。
若有1摩尔焦炭与足量的SiO2、氮气反应,电子转移数 摩尔,理由是查看答案和解析>>
科目: 来源: 题型:
(08上海松江区期末)在①NH4NO3中氮元素显+5价; ②4FeS2+11O2 → 2Fe2O3+8SO2反应中+2价铁和-2价硫都被氧化;③氧化还原反应中还原剂得电子数与氧化剂失电子数一定相等.这3种说法中错误的是( )
A.① B.②③ C.①③ D.①②③
查看答案和解析>>
科目: 来源: 题型:
(08松江区模拟)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。
现有一氧化还原反应的体系中,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)写出上述体系中发生的氧化还原反应方程式,并标出电子转移的方向和数目。
(2)上述反应中,还原剂是______________,1 mol氧化剂在反应中_________(填“得到”或“失去”)___________mol电子。
(3)如果在反应后的溶液中加入NaBiO3,则溶液又变紫红色。据此说明不能用盐酸酸化NaBiO3的原因。
查看答案和解析>>
科目: 来源: 题型:
(10分) 科学家用NaNO3和Na2O在一定条件下等物质的量化合制得晶体A,A由钠离子和某阴离子B构成, 则:
(1)A的化学式为 , A 与Na3PO4比较,其稳定性A Na3PO4(填“>”或“<”),阴离子B的空间结构最有可能是 (填序号);
①直线型 ②平面三角形 ③三角锥形 ④正四面体
(2)A对CO2特别敏感,与CO2反应相当剧烈,生成两种常见的物质,该反应的化学方程式为: ;
(3)此外,科学家还制备了另一种钠盐D,其与A的组成元素完全相同,D中的阴离子与A中的阴离子表观形式相同(元素种类和原子个数均相同),但D中阴离子的结构中含有一个过氧键:-O-O- ,电导实验表明,同条件下其电导能力与NaCl相同,该阴离子的化学式为 ,其与水反应生成过氧化氢的离子方程式为 ,该反应 (填“是”或“不是”)氧化-还原反应。
查看答案和解析>>
科目: 来源: 题型:
将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用l mol?L-1的盐酸滴定,至沉淀质量最大时,消耗盐酸40 mL,原合金中钠的质量为
A.0.46 g B.0.69 g C.0.92 g D.0.23 g.
查看答案和解析>>
科目: 来源: 题型:
以下均为中学化学中的常见实验装置,下列有关说法不正确的是

A.装置①用于分离沸点不同的两种液态有机物,装置④适用实验室制取少量乙酸乙酯
B.装置②可用于检验碳酸钠与碳酸氢钠两种固体
C.装置③,可用于CO还原氧化铁实验
D.装置⑤,选择合适药品时,可用于制备少量氨气及氧气等
查看答案和解析>>
科目: 来源: 题型:
某芳香族酯类化合物甲的分子式为C14H10O5,1mol甲水解后只生成一种产物乙,其物质的量为2mol,下列说法正确的是
A.符合上述条件的甲共有3种 B.1mol甲最多可以和3molNaOH反应
C.乙不能和溴水发生反应 D.2mol乙最多消耗1molNa2CO3反应
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z、W是原子序数依次增大的四种常见元素。W和Y元素形成的化合物W3Y4具有磁性。X的单质在Y2中燃烧可生成XY和XY2两种气体。Z的单质是一种金属,该金属在XY2中剧烈燃烧生成黑、白两种固体。下列说法错误的是
A.W3Y4的化学式为Fe3O4
B.W在地壳中的含量居第四位
C.XY和XY2分别是NO和NO2
D.Z在XY2中燃烧生成的白色固体是一种氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com