
科目: 来源: 题型:
(08上海建平中学期末)元素周期表中前七周期的元素种数如下表,请分析周期数与元素种数的关系.预言第八周期最多可能含有的元素种数为 ( )
周期 | 一 | 二 | 三 | 四 | 五 | 六 | 七 |
元素种数 | 2 | 8 | 8 | 18 | 18 | 32 | 32 |
A.18种 B.32种 C.50种 D.64种
查看答案和解析>>
科目: 来源: 题型:
(10分)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,反应均生成Cu2+、Mn2+、SO2和H2O,其中Cu2S与酸性KMnO4溶液反应的离子方程式为:
8MnO4-- + 5Cu2S + 44H+ == 10Cu2+ + 5SO2 + 8Mn2+ + 22H2O
反应后煮沸溶液,赶尽SO2,取出剩余溶液的十分之一用0.1mol/L(NH4)2Fe(SO4)2溶液滴定,终点时恰好用去35.00mL (NH4)2Fe(SO4)2溶液,反应的离子方程式为:
MnO4-- + 5Fe2+ + 8H+ == Mn2+ + 5Fe3+ + 4H2O
(1)写出该条件下CuS与酸性KMnO4溶液反应的离子方程式:
;在此反应中,若生成22.4LSO2(标准状况),则反应中转移的电子为 mol。
(2)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2•6H2O (M=392g/mol)的质量为 g,配制时所需要的定量仪器是 。
(3)求混合物中CuS的质量分数。
查看答案和解析>>
科目: 来源: 题型:
(10分)2gCu2S和CuS的混合物在酸性溶液中用400mL0.075mol/LKMnO4溶液处理,反应均生成Cu2+、Mn2+、SO2和H2O,其中Cu2S与酸性KMnO4溶液反应的离子方程式为:
8MnO4-- + 5Cu2S + 44H+ == 10Cu2+ + 5SO2 + 8Mn2+ + 22H2O
反应后煮沸溶液,赶尽SO2,取出剩余溶液的十分之一用0.1mol/L(NH4)2Fe(SO4)2溶液滴定,终点时恰好用去35.00mL (NH4)2Fe(SO4)2溶液,反应的离子方程式为:
MnO4-- + 5Fe2+ + 8H+ == Mn2+ + 5Fe3+ + 4H2O
(1)写出该条件下CuS与酸性KMnO4溶液反应的离子方程式:
;在此反应中,若生成22.4LSO2(标准状况),则反应中转移的电子为 mol。
(2)欲配制500mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2•6H2O (M=392g/mol)的质量为 g,配制时所需要的定量仪器是 。
(3)求混合物中CuS的质量分数。
查看答案和解析>>
科目: 来源: 题型:
(10分)氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
Cu2+ Fe2+ Fe3+ | 4.7 7.0 1.9 | 6..7 9.0 3.2 |
(1)操作I加入X的目的是 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项) 。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式) ,并调节溶液的pH在 范围。
(4)操作III的程序依次为 、 、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示);
。
查看答案和解析>>
科目: 来源: 题型:
(10分)氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
Cu2+ Fe2+ Fe3+ | 4.7 7.0 1.9 | 6..7 9.0 3.2 |
(1)操作I加入X的目的是 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项) 。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式) ,并调节溶液的pH在 范围。
(4)操作III的程序依次为 、 、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示);
。
查看答案和解析>>
科目: 来源: 题型:
(10分)氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
Cu2+ Fe2+ Fe3+ | 4.7 7.0 1.9 | 6..7 9.0 3.2 |
(1)操作I加入X的目的是 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项) 。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式) ,并调节溶液的pH在 范围。
(4)操作III的程序依次为 、 、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示);
。
查看答案和解析>>
科目: 来源: 题型:
(10分)氯化铜晶体(CuCl2•2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
Cu2+ Fe2+ Fe3+ | 4.7 7.0 1.9 | 6..7 9.0 3.2 |
(1)操作I加入X的目的是 。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项) 。
A.KMnO4 B.H2O2 C.NaClO D.Cl2
(3)操作II的Y试剂为(填化学式) ,并调节溶液的pH在 范围。
(4)操作III的程序依次为 、 、过滤、自然干燥、得到CuCl2•2H2O晶体。
(5)实验室在配制CuCl2溶液时需加入少许盐酸的理由是(文字叙述并用有关离子方程式表示);
。
查看答案和解析>>
科目: 来源: 题型:
(10分)实验室利用足量的NH3在加热的条件下与CuO充分反应生成Cu、N2、H2O,并测定Cu的相对原子质量。装置图如下:

(1)连接好装置后检验装置气密性的方法是
。
(2)用装置A、B制取纯净、干燥的氨气,大试管内碳酸盐的化学式为: ,装置B中碱石灰的作用是: 。
(3)实验中观察到C装置的E管中产生的现象有: ,E管中发生反应的化学方程式为: 。
(4)从实验中测得了下列数据:
①空E管的质量a;
②实验前E管和CuO的总质量b;
③充分反应后E管和Cu粉的总质量c(冷却到室温,干燥后称量);
④充分反应后D管及内盛物质的总质量d
请选择合理的数据列出计算Cu的相对原子质量的计算式(除Cu外,其它涉及到的元素的相对原子质量均为已知);Ar(Cu)== 。
查看答案和解析>>
科目: 来源: 题型:
(10分)实验室利用足量的NH3在加热的条件下与CuO充分反应生成Cu、N2、H2O,并测定Cu的相对原子质量。装置图如下:

(1)连接好装置后检验装置气密性的方法是
。
(2)用装置A、B制取纯净、干燥的氨气,大试管内碳酸盐的化学式为: ,装置B中碱石灰的作用是: 。
(3)实验中观察到C装置的E管中产生的现象有: ,E管中发生反应的化学方程式为: 。
(4)从实验中测得了下列数据:
①空E管的质量a;
②实验前E管和CuO的总质量b;
③充分反应后E管和Cu粉的总质量c(冷却到室温,干燥后称量);
④充分反应后D管及内盛物质的总质量d
请选择合理的数据列出计算Cu的相对原子质量的计算式(除Cu外,其它涉及到的元素的相对原子质量均为已知);Ar(Cu)== 。
查看答案和解析>>
科目: 来源: 题型:
(8分)下图表示某典型金属单质A与其化合物之间的转化关系(某些产物和反应条件已略去)。已知:图中所示物质中的组成元素均为短周期元素,化合物C中含有两种金属元素,反应⑤用于工业制取A,反应⑥的产物过滤后得到化合物D的溶液呈碱性。
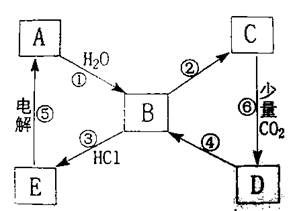
(1)一步实现图中①至⑥的转化关系中一定属于复分解反应的是(填序); 。
(2)写出一步实现反应④所需加入的化学试剂(填化学式); 。
(3)写出反应①的离子反应方程式: 。
(4)B→C的转化有多种途径,试写出其中两种不同反应类型的化学反应方程式:
;
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com