
科目: 来源: 题型:
(08黄埔区4月模拟)下列事实中,不能用勒夏特列原理加以解释的是()
A.夏天,打开啤酒瓶时会在瓶口逸出气体
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D.将盛有二氧化氮和四氧化二氮混合气的密闭容器置于冷水中,混合气体颜色变浅
查看答案和解析>>
科目: 来源: 题型:
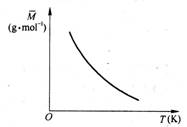 (08黄埔区4月模拟)已知反应2A(g)
(08黄埔区4月模拟)已知反应2A(g) ![]() B(?)+ 2C(?) - Q (Q>O),满足如图所示的关系,则下列说法中正确的是 ()
B(?)+ 2C(?) - Q (Q>O),满足如图所示的关系,则下列说法中正确的是 ()
A.B、C可能均为非气态
B.若B是气态,则C一定也只能是气态
C.若B为固态,则C一定为气态
D.B、C可能均是气态
查看答案和解析>>
科目: 来源: 题型:
.(08黄埔区4月模拟).在一恒容密闭容器中发生某化学反应2A(g) ![]() B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示:
B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ都在800℃,实验Ⅲ在850℃,B、C的起始浓度都为0,反应物A的浓度(mol?L-1)随时间(min)的变化如图所示:

试回答下列问题:
(1)在实验Ⅰ中,反应在20min至40min内A的平均反应速率为___________mol?L-1min-1。
(2)实验Ⅱ和实验I相比,可能隐含的反应条件是_____________________________。
(3)根据实验Ⅲ和实验Ⅰ的比较,可推测该反应降低温度,平衡向_____(填“正”或“逆”)反应方向移动,该正反应是_________(填“放热”或“吸热”)反应。
(4)与实验Ⅰ相比,若实验Ⅰ中的A的起始浓度改为0.8 mol?L-1,其它条件不变,则达到平衡时所需用的时间___________实验Ⅰ(填写“大于”、“等于”或“小于”)。
查看答案和解析>>
科目: 来源: 题型:
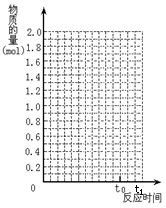 (08闽行区模拟) (8分)将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:
(08闽行区模拟) (8分)将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:
2SO2(g)+O2(g)![]() 2SO3(g) + Q
2SO3(g) + Q
当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
(1)该反应的平衡常数表达式为 。
(2)反应进行到t0时SO2的体积分数为 。
(3)保持温度不变,若使用催化剂,在图中作出从反应开始到t0点这段时间SO2物质的量变化曲线。
(4)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度T2 (T2>T1),反应在t2 时间时(t2>t1)重新达到平衡状 态,新平衡混合物中气体的总物质的量 ______2.1 mol(填“<”、“>”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
(08上海12校第二次联考)右图中的两条曲线分别代表的是:1gC3H6
和1gM气体在相同体积的容器中,测得容
器中的压强和温度的关系,试根据图形判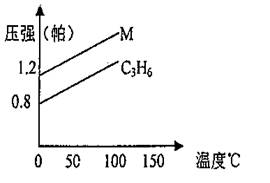
断M气体可能是 ( )
A.C3H8 B.C2H4
C.H2S D.N2O4
查看答案和解析>>
科目: 来源: 题型:
(08上海12校第二次联考)下列事实不能用勒沙特列原理解释的是 ( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体;
②铁在潮湿的空气中容易生锈;
③实验室可用排饱和食盐水的方法收集氯气;
④常温下,将1mL pH=3的醋酸溶液加水稀释至100mL,测得其pH<5;
⑤钠与氯化钾共融制备钾Na(1)+KC1(1) ![]() K(g)+NaC1(1);
K(g)+NaC1(1);
⑥二氧化氮与四氧化氮的平衡体系,加压后颜色加深
A.①②③ B.只有②⑥ C.③④⑤ D.②⑤⑥
查看答案和解析>>
科目: 来源: 题型:
(08上海12校第二次联考)Mg的焦炭与Xg的O2置于密闭容器中,在一定条件下充分反应后恢复到原来的温度,容器中反应物均无剩余。设反应前后压强分别为P1、P2,以下说法正确的是 ( )
A.如果P1=P2,m≥3X/8 B.如果2P1=P2,m≤3X/4
C.如果P1<P2<2P1,3x/4>m>3X/8 D.无论前后压强如何变化, m=3X/8
查看答案和解析>>
科目: 来源: 题型:
(08上海12校第二次联考)合成氨的反应在一定条件下已达到平衡状态:N2+3H2 ![]() 2NH3+Q。
2NH3+Q。
(1)用氢气表示正反速率,氨气表示逆反应速率,两者的关系式为 。
(2)若降低温度,V正 (填增大、不变、减小),平衡向 移动,若生成每摩尔氨气的反应热是46.2千焦,则上述反应的热化学方程式为 。
(3)若增加氢气的浓度,氮气的转化率 ;若将氨分离出来,化学平衡常数 。
(填增大、减小、不变)
(4)请在右图定性表示H2的逆反应速率
变化与时间的关系图象,相应的变化特点为:t1达平衡、t2降温、t3又达平衡、t4增压、t5再次达平衡。

查看答案和解析>>
科目: 来源: 题型:
(08上海重点中学第二次联考) 500℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3物质的量变化如图所示,根据题意完成下列各题:
( 1 ) 反应达到平衡时,平衡常数表达式 K=___________________
 此时增加N2的量,平衡常数将______________(填“增大”“减小” 或 “不变”)
此时增加N2的量,平衡常数将______________(填“增大”“减小” 或 “不变”)
( 2 ) 500℃、20 MPa时,反应处于平衡状态的时间
______________________________ 。
( 3 ) 反应开始到第一次平衡时,N2的平均反应速率为
_______________________________。
( 4 ) 据图判断,反应进行到10 min至20 min时曲线发
生变化的原因是:______________________ ;反应进行至25min时,曲线发生变化的原因是:____________________________________________ 。
查看答案和解析>>
科目: 来源: 题型:
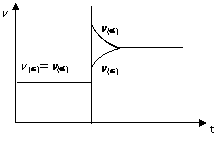 (08上海重点中学第二次联考) 在一体积不变的密闭容器中充入H2和I2(g),发生反应:H2(g)+I2(g)
(08上海重点中学第二次联考) 在一体积不变的密闭容器中充入H2和I2(g),发生反应:H2(g)+I2(g)![]() 2HI(g)+Q,Q>0。当达到平衡后,改变反应的某一条件(不再充任何气体)造成容器内压强增大。下列说法正确的是()
2HI(g)+Q,Q>0。当达到平衡后,改变反应的某一条件(不再充任何气体)造成容器内压强增大。下列说法正确的是()
A.容器内气体颜色变深,平均相对分子质量增大
B.平衡不移动,混合气体密度不变
C.平衡向右移动,HI浓度增大
D.反应速率变化如右图所示
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com