
科目: 来源: 题型:
(08上海卢湾区期末)在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12 L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0 L,溶液中NaOH的浓度为0.050mol?L-1(忽略溶液中离子的水解和溶解的氢气的量)。该实验中发生反应的化学方程式有:①2Na+2H2O→2NaOH+H2↑ ②Na2O+H2O→2NaOH ③2Al+2NaOH+2H2O→2NaAlO2+3H2↑。 试计算:
(1) 由铝生成的氢气的物质的量为_____。
(2)由金属钠生成的氢气(标准状况)的体积为_____。
(3)该钠块中n(Na):n(Na2O)为_______。
查看答案和解析>>
科目: 来源: 题型:
(08上海建平中学期末)取一定量的Na2CO3、NaHCO3、Na2SO4混合物与250ml 1.00mol/L过量盐酸反应,生成2.016升CO2 (标准状况),然后加入500ml 0.100mol/LBa(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0ml 1.00mol/L盐酸恰好中和。计算混合物中各物质的质量。
查看答案和解析>>
科目: 来源: 题型:
(2008年上海卷)研究发现,空气中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2→SO3+NO ②SO3+H2O→H2SO4 ③2NO+O2→2NO2
NO2在上述过程中的作用,与H2SO4在下述变化中的作用相似的是:
A.潮湿的氯气通过盛有浓H2SO4的洗气瓶
B.硫化氢通入浓H2SO4
C.浓H2SO4滴入萤石中,加热
D.加入少量的H2SO4使乙酸乙酯水解
查看答案和解析>>
科目: 来源: 题型:
(08上海松江区期末)铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。(主要成分为盐酸)
某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

⑴ 试剂1是 ,试剂2是 ,加入新制氯水后溶液中发生的离子
反应方程式是 , 。
⑵该同学猜想血红色溶液变为无色溶液液的原因是溶液中的+3价铁被还原为+2价铁,你认为该同学的猜想合理吗? 。若你认为合理,请说明理由(若你认为不合理,该空不要作答) ;若你认为不合理请提出你的猜想并设计一个简单的实验加以验证(若你认为合理,该空不要作答) 。
⑶该药品须密封保存,若表面出现颜色变化,说明部分+2价铁已变成+3价铁。 药品中经常放入维生素C,可以延长保质期。请你解释原因 。
查看答案和解析>>
科目: 来源: 题型:
(08上海松江区模拟)工业上用苦卤为原料制碱式碳酸镁,可表示为aMgCO3?Mg(OH)2?bH2O。取4.84克碱式碳酸镁在坩埚中充分加热,得到2.00克固体;另取4.84克碱式碳酸镁加入足量盐酸,可产生896 mL的气体(标况下)。
(1)求a、b的值。
(2)若把4.84克上述碱式碳酸镁溶于适量的稀盐酸中,小心蒸干溶液,可得组成为Mg5(OH)Cl9的固体多少克?
查看答案和解析>>
科目: 来源: 题型:
(08上海闵行区模拟)将一定质量的镁和铝的混合物投入100 mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如下图所示。若不考虑金属和盐酸反应时HCl的挥发,则下列说法正确的是 ()
A.镁和铝的总质量为9 g
B.生成的氢气在标准状况下的体积为11.2L
C.盐酸的物质的量浓度为6 mol/L
D.NaOH溶液的物质的量浓度为5 mol/L
查看答案和解析>>
科目: 来源: 题型:
(08上海黄埔区4月模拟)某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了较全面的感性认识。请你参与计算该社会实践活动小组感兴趣的问题:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g Fe2O3。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况)。
① 计算此钢样粉末中铁和碳的物质的量之比。
② 再取三份不同质量的钢样粉末分别加到100mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
实验序号 | Ⅰ | Ⅱ | Ⅲ |
加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度为多少?
③ 若在实验Ⅱ中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
(8分)黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取1.000 g样品在空气中充分煅烧,将生成的SO2气体与KMnO4浓度为0.2000mol/L的高锰酸钾酸性溶液25.00 mL恰好完全反应,此时高锰酸钾被还原为Mn2+。
⑴写出SO2与酸性高锰酸钾溶液反应的离子方程式
⑵样品中FeS2的质量分数是(假设杂质不参加反应) 。
⑶煅烧1kg上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,能制得98%硫酸_________kg。
查看答案和解析>>
科目: 来源: 题型:
(14分)某课外活动小组设计了以下实验方案验证Ag与浓硝酸反应的过程中可能产生NO。其实验流程图如下:
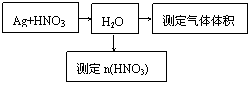
(1)测定硝酸的物质的量
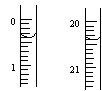
反应结束后,从下图B装置中所得100mL溶液中取出25.00mL溶液,用0.1mol?L-1的NaOH溶液滴定,用酚酞作指示剂,滴定前后的滴定管中液面的位置如上图所示。在B容器中生成硝酸的物质的量为 mol,则Ag与浓硝酸反应过程中生成的NO2体积为 mL。
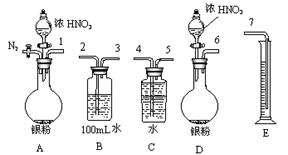
(2)测定NO的体积
①从上图所示的装置中,你认为应选用 装置进行Ag与浓硝酸反应实验,选用的理由是 。
②选用上图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是
(填各导管口编号)。
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置 (“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平.
(3)气体成分分析
若实验测得NO的体积为112.0mL(已折算到标准状况),则Ag与浓硝酸反应的过程中 (填“有”或“没有”)NO产生,作此判断的依据是 。
查看答案和解析>>
科目: 来源: 题型:
(12分)X、Y、Z、W四种元素的原子序数依次增大,且均为短周期元素。X原子最外层电子数是次外层电子数的2倍;Y有两种常见的同素异形体,其中一种是很好的脱色剂和消毒剂。Z、W原子最外层电子数之和是X原子最外层电子数的2倍,这四种元素的原子电子层数之和为10。请填空:
(1)X与Y组成一种有特殊臭味的气体,已知该气体与氧气按物质的量之比为1:2混合后恰好完全燃烧,生成稳定的氧化物,在同温同压下测得燃烧前后气体的总体积不变,该反应的化学方程式为 。
(2)若W的单质是有毒气体,则它与强碱溶液反应的离子方程式为
;
由Z和Y可构成具有漂白作用的化合物,其电子式为 。
(3)若W的单质为黄色固体,且W与X可形成化合物XW2。
①XW2为结构式为 ;
②Z的单质在XY2气体中燃烧的现象为 。
(4)若W的一种单质分子为正四面体结构,可用于制造燃烧弹和烟幕弹等。实验室里少量该单质应保存在 中。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com