
科目: 来源: 题型:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活
化分子。使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ?mol-1表示。请认真观察右图,然后回答问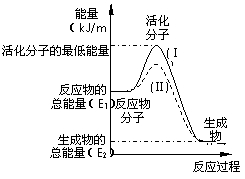 题。
题。
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应_______(填“需要”或“不需要”)加热,
该反应的△H =____ ____ (用含E1、E2的代数式表示)。
(2)已知热化学方程式:H2(g)+![]() O2(g) = H2O(g) △H = - 241.8 kJ?mol-1,该反应的活化能为167.2 kJ?mol-1,则其逆反应的活化能为____________________。
O2(g) = H2O(g) △H = - 241.8 kJ?mol-1,该反应的活化能为167.2 kJ?mol-1,则其逆反应的活化能为____________________。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,活化分子百分数增多,反应速率加快,你认为最可能的原因是_________________________。
查看答案和解析>>
科目: 来源: 题型:
在溶液中进行某化学反应 2A ![]() B + D 在四种不同条件下进行,B、D 起始浓度为零,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如下表 :
B + D 在四种不同条件下进行,B、D 起始浓度为零,反应物 A 的浓度(mol/L)随反应时间(min)的变化情况如下表 :
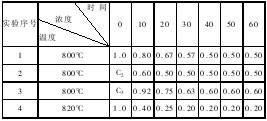
根据上述数据,完成下列填空:
(1)在实验 1,反应在 10至 20分钟时间内平均速率(VA)为 mol/(L?min)。
(2)在实验 2,A 的初始浓度 C2= mol/L,反应经 20分钟就达到平衡,可推测实验 2中还隐含的条件是 。
(3)设实验 3的反应速率为 v3,实验 1的反应速率为 v1,则 v3 v1(填“ > ”、“ = ”、“ < ”),且 C3 1.0mol/L(填“ > ”、“ = ”、“ < ”)
(4)比较实验 4和实验 1,可推测该反应是 反应(选填吸热、放热)。理由是 。
查看答案和解析>>
科目: 来源: 题型:
二氧化氮在加热条件下能够分解成一氧化氮和氧气。该反应进行到 45s时,达到平衡(NO2浓度约为 0.0125mol?L-1)。右图中的曲线表示二氧化氮分解反应在前 20s内的反应进程。
(1)请计算前 25s内氧气的平均生成速度。
(2)若反应延续至 70s,请在右图中用实线画出 25s至 70s的反应进程曲线。
(3)若反应开始时加入催化剂(其他条件都不变)请在图上用虚线画出加入催化剂后的反应进程曲线。
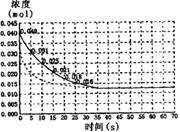
查看答案和解析>>
科目: 来源: 题型:
从下列实验事实所引出的相应结论正确的是
选项 | 实验事实 | 结论 |
A | 其他条件相同,Na2S2O3溶液浓度越大,析出硫沉淀所需时间越短 | 当其他条件不变时,增大反应物浓度化学反应速率加快 |
B | 在化学反应前后,催化剂的质量和化学性质都没有发生改变 | 催化剂一定不参与化学反应 |
C | H+浓度相同的盐酸和醋酸分别与等质量的形状相同的锌粒反应 | 反应开始速率相同 |
D | 在容积可变的密闭容器中发生反应H2(g)+I2(g) | 正反应速率加快,逆反应速率不变 |
查看答案和解析>>
科目: 来源: 题型:
在锌与某浓度的盐酸起反应的实验中,一个学生得到下面的结果:
序号 | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于水的时间/s |
A | 2 | 薄片 | 5 | 400 |
B | 2 | 薄片 | 15 | 200 |
C | 2 | 薄片 | 25 | 100 |
D | 2 | 薄片 | 30 | t1 |
E | 2 | 薄片 | 35 | 50 |
F | 2 | 颗粒 | 15 | t2 |
G | 2 | 粉末 | 15 | t3 |
则下列说法正确的是
①t1=75s ②t2>200>t3 ③单位时间内消耗的锌的质量mG>mF>mB
A、① B、①② C、只有② D、全部正确
查看答案和解析>>
科目: 来源: 题型:
在一个密闭、恒容的容器中进行下列反应:4NH3(g)+ 5O2(g)![]() 4NO(g)+6H2O(g)在一定的条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是
4NO(g)+6H2O(g)在一定的条件下达到平衡,现向反应容器中通入少量的氯化氢气体,产生的结果是
A.容器内压强增大 B.原平衡不受影响 C.正反应速率增大 D.NO 浓度降低
查看答案和解析>>
科目: 来源: 题型:
(08安庆模拟)2006年1月12日美国升空的探测器在7月4日与“彗星相撞,产生4.5吨
TNT当量爆炸威力。其火箭推进剂仍然以肼(N2H4)作为主要燃料,NO2为氧化剂,反应生成
N2和水蒸气。已知N2(g)+2O2(g)= 2NO2(g);ΔH= +67.7KJ/mol,
N2H4(g)+O2(g)=N2(g)+2H2O (g);ΔH= ―534KJ/mol。下列关于肼和NO2反映的热化学方程式中,正确的是( )
A. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (l); ΔH= ―1135.7KJ/mol
B. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (g); ΔH= ―1000.3KJ/mol
C. N2H4(g)+ NO2(g)=![]() N2(g)+2H2O (l); ΔH= ―1135.7KJ/mol
N2(g)+2H2O (l); ΔH= ―1135.7KJ/mol
D. 2 N2H4(g)+2 NO2(g)=3 N2(g)+4H2O (g); ΔH= ―1135.7KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com