
科目: 来源: 题型:
(08福州八中质检)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中A为化合物,甲可由两种单质直接化合得到,乙为金属单质,G为酸,乙在G的浓溶液中发生钝化。有的反应中反应物和生成物未全部给出,反应条件也未注明。
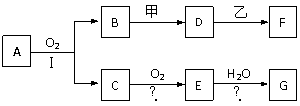 |
(1)若A为硫酸工业的重要原料,C能使品红褪色,D的水溶液中加入HNO3酸化的AgNO3溶液有白色沉淀生成,A和乙含一种相同的元素。则
①A的的化学式为 ,工业上反应Ⅱ在 中进行(填设备名称),工业上反应Ⅲ用于吸收E的试剂是 。
②用烧碱溶液检验F溶液中所含阳离子时观察到的现象为
其中发生了氧化还原反应的化学方程式为
(2)若甲为淡黄色固体,D、F的溶液均呈碱性,用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近,有大量白烟生成。则
①写出B和甲反应的化学方程式_______________________。
②写出D溶液与乙反应的离子方程式
③E→G的化学方程式: ________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(08南安华侨中学专项训)把铝粉和氧化亚铁粉配成铝热剂,分成两等份。一份在高温下恰好完全反应后, 再与足量盐酸反应;一份直接放入足量的烧碱溶液中充分反应。前后两种情况下生成气体的质量比是 ( )
A. 28∶9 B. 1∶1 C. 3∶2 D. 2∶3
查看答案和解析>>
科目: 来源: 题型:
(08南安华侨中学专项训)有一不饱和的NaOH溶液。加入a mol Na2O、b mol Na2O2或c mol NaOH。恰好得到NaOH饱和溶液(同一温度下).则a、b、c的关系为 ( )
A.a=b=c/2 B.a=b>c/2 C.a=b
查看答案和解析>>
科目: 来源: 题型:
(08年福建省质检)硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
指标 项目 | 优等品 | 一等品 | 合格品
|
外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
氮(N)含量 | ≥21.0% | ≥21.0% | ≥20. 5% |
新华中学化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验探究]按右图所示装置进行实验。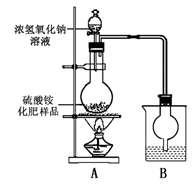
(1)烧瓶内发生反应的离子方程式为:
烧杯中盛放的试剂最好是 (填“浓硫酸”、“稀硫酸”或“水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是
。 [交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:
乙同学:实验装置中还存在另一个明显缺陷是:
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验前后B装置增重3.40 g。该化肥 (填“是”或“不是”)一等品。
查看答案和解析>>
科目: 来源: 题型:
(07年上海卷)已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是()
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是()
A. 加少量烧碱溶液 B.升高温度 C. 加少量冰醋酸 D. 加水
查看答案和解析>>
科目: 来源: 题型:
(08年福建省质检)下列各组物质发生反应时,生成物不因反应条件(浓度、温度或催化剂)的不同而不同的是( )
A.Cu与HNO3 B.C2H5OH与O2
C.Na与O2 D.SO2与O2
查看答案和解析>>
科目: 来源: 题型:
(08年福建省质检)用下图所示装置进行实验。

实验步骤:检查气密性;装入少许白磷、红磷;打开夹子K,通入氧气;点燃酒精灯(加热位置如图所示)。
(1)该实验主要用于比较白磷和红磷的 ,还能证明“磷能在氧气中燃烧”。在硬质玻璃管中可以观察到有 (填“白烟”或“白雾”)生成。
(2)该实验符合化学实验设计“环保策略”,主要体现在:
查看答案和解析>>
科目: 来源: 题型:
(08福州八中质检) (NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4 ==== N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,将反应后的混合气体通入BaCl2溶液,产生的沉淀为 ()
A.BaSO4 B.BaSO3 C.BaS D.BaSO4和BaSO3
查看答案和解析>>
科目: 来源: 题型:
(08福州八中质检)NO很容易与许多分子迅速发生反应,科学家发现在生命体中会不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式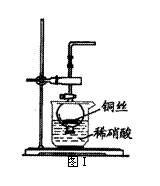
(2)NO是有毒气体,某学生为防止污染,用分液漏
斗和烧杯装配了一套简易的、能随开随用、随关
随停的NO气体发生装置,如图Ⅰ所示。
①实验室若没有铜丝,而只有小铜粒,在使用上
述装置进行实验时,可用丝状材料包裹铜粒以代
替铜丝进行实验,这丝状材料的成分可以是
(填选项编号)
(A)铁 (B)铝 (C)银 (D)玻璃 (E)聚丙烯塑料
②打开分液漏斗的活塞使反应进行,在分液漏斗
中实际看到的气体是红棕色的,原因是 (填化
学方程式)
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某同学
另设计了一套如图Ⅱ所示制取NO的装置。反应开始
后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是 。
②让反应停止的操作方法及原因是
(4)以下收集NO气体的装置(见图Ⅲ,图在下页),合理的是 (填选项代号)
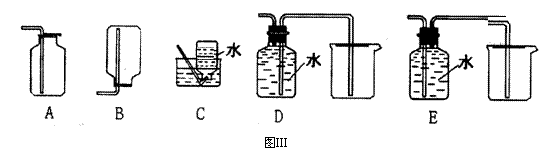 |
查看答案和解析>>
科目: 来源: 题型:
(08鄞州中学月考)膦(PH3)是一种无色有剧毒的气体,其还原能力比氨(NH3)强,是一种强还原剂,但膦在水中的溶解度远小于氨,微溶于水。某反应体系中存在下列物质:Cu、H2SO4、CuSO4、PH3、H3PO4、H2O。回答下列问题:
⑴ P在元素周期表中的位置是 ,PH3的电子式为 ;
⑵ 上述反应体系中化学反应方程式为 ,氧化产物是 ;
⑶ 膦(PH3)在水中的溶解度远小于氨的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com