
科目: 来源: 题型:阅读理解
(08山东省潍坊一中模拟)(12分)类比是化学学习中常用的方法之一,已知硝酸能把铁氧化成 Fe ( NO3)3,但当铁过量时,产物是 Fe (NO3) 2 。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当 C12 足量时生成 FeC13 , 当铁粉过量时产物是 FeCl2。为验证该观点是否正确,该同学将一根细的纯铁丝分别在足量和少量的 C12 中点燃,取其表面生成物并分别编号为 A、B ,然后通过实验确定其成分。探究过程如下:
(1)提出假设: A 是 FeCl3, B 是 FeCl2。
(2)设计实验方案:分别取 A、B 的溶液均进行以下实验,但实验现象相同。请填写下表中的相应空格。

(3)根据上述实验结论,写出C12与铁粉加热时发生反应的化学方程式:________。
(4)为进一步探究 FeC13 溶液的性质,他又利用 A 溶液做了如下一些实验,其中明显错误的是_______________(填写序号)。
A.将 A 溶液滴入淀粉碘化钾溶液中,可得到蓝色液体,该液体能产生丁达尔现象
B.向 A 溶液中加入少量铁粉,铁粉溶解,溶液颜色加深
C.在 A 溶液中滴加NaOH浓溶液,出现红褐色沉淀
D.将 A 溶液加热蒸干并灼烧,得到FeC13固体
(5)FeCl3溶液常作印刷电路铜板腐蚀剂,腐蚀后的废液中含有 FeC13、FeCl2、CuCl2,某研究性学习小组的同学们设计了两种从废液中回收 Cu的方案:
方案1:向废液中加入过量的铁粉,充分反应后,过滤。在所得滤渣中加入足量的盐酸,充分反应后,再过滤即得到铜。该方案中涉及的四种阳离子的氧化性由强到弱的顺序为:
_____________________________________。
方案2 :在废液中加入适量的盐酸调节溶液的 pH = 1 ,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的 Cu 已全部析出。该方案中铜作_________极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)______________________________________________________________。
方案 2 在电极上直接回收铜,操作上比方案 1 简便,但方案 2 也有不足之处,主要表现为:_____________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(08山东临沂质检)(7分)下图表示各物质之间的转化关系。已知:A、D、F、H 均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:

(1)写出生成E的电极反应式: ,反应⑤的现象是
(2)反应①的化学方程式是 ,在实验室中引发反应④的操作是
(3)反应⑥的离子方程式是
查看答案和解析>>
科目: 来源: 题型:
(08山东临沂质检)电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+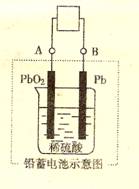 4H++ 2SO4+
4H++ 2SO4+![]() 2PbSO4 +2H2O
2PbSO4 +2H2O
则下列说法正确的是 ()
A. 放电时:电流方向由B到A
B. 充电时:阳极反应是PbSO4 - 2 e- + 2H2O = PbO2 + SO42- +4H+
C. 充电时:铅蓄电池的负极应与充电器电源的正极相连
D. 放电时:正极反应是 Pb - 2e- +SO42- = PbSO4
查看答案和解析>>
科目: 来源: 题型:
(08山东实验中学诊断)(8分)(1) 发射卫星时可用肼(N2 H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。已知:
N2 (g) + 2O2 (g) = 2NO2 (g) △H = + 67.7kJ?mol -1
N2 H4 (g) +O2 (g) = N2 (g) +2H2 O (g) △H = -543 kJ?mol -1
0.5H2 (g) + 0.5F2 (g) = HF (g) △H = -269 kJ?mol -1
H2 (g) +0.5O2 (g) = H2 O (g) △H = -242 kJ?mol -1
①肼和NO2反应的热化学方程式_____ _。
②有人认为若用氟气代替二氧化氮作氧化剂,则反应释放的能量更大,肼和氟气反应的热化学方程式: 。
(2)最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为 ____ ;
②放电时固体电解质里的O2-离子的移动方向是向 极移动(填正或负)。
查看答案和解析>>
科目: 来源: 题型:
(07年江苏卷)16.某合金(仅含铜、铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入50mLbmol?L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。下列说法正确的是()
A.若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解
B.若金属全部溶解,则溶液中一定含有Fe3+
C.若金属全部溶解,且产生336mL气体(标准状况),则b=0.3
D.当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)
查看答案和解析>>
科目: 来源: 题型:
(08枣庄三诊)氮是地球上含量丰富的一种元素,氮及其化合拖把在工农业生产、生活中有着重要作用。请回答:
(1)右图是1molNO2和1molCO反应
生成CO2和NO过程中能量变化
示意图,请写出NO2和CO反应
的热化学方程式 。
(2)在一定体积的密闭容器中,进行如
下化学反应: N2(g)+3H2(g) ![]() 2NH3(g),
2NH3(g),
其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小;K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保护不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出墁酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5?H2O+])+c(H+)= c(H+)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)>
查看答案和解析>>
科目: 来源: 题型:阅读理解
(08枣庄调研)燃料和能源是化学知识与社会生活联系极为密切的内容。我们要关注矿物能源的合理利用,积极研究、开发新能源。
(1)新能源应该具有原状料易得、燃烧时产生的热量多且不会污染环境特点。在煤炭、石油、煤气、氢气中,前途广阔的能源是 。
(2)近年来,我国煤矿事故大多是由于瓦斯暴炸所致。瓦斯中含有甲烷和一氧化碳等气体,当矿井中瓦斯浓度达到一定范围时遇明火即燃烧爆炸。为避免灾难的发生应采取的切实可行的措施有 (填序号)
①加强安全管理,杜绝明火源 ②降低瓦斯气体的着火点
③提高通风能力 ④将矿井中的氧气抽去
(3)为了提高煤的热效应,同时减少燃烧时的环境污染,常将煤转化为水煤气,这是将煤转化为洁净燃料的方法之一。水煤气的主要成分是一氧化碳的氢气,它是由煤炭和水蒸气反应制得,已知C(石墨)、CO、H2燃烧的热化学方程式为:
C(s,石墨)+O2(g) CO2(g)△H1=-393.5kJ?mol-1
H2(g)+![]() O2(g)
O2(g) H2O(g)△H2=-241.8kJ?mol-1
CO(g)+O![]() 2(g)
2(g) CO2(g)△H3=-283.0kJ?mol-1
H2(g)+![]() O2(g)
O2(g) H2O(1)△H4=-285.8kJ?mol-1
请回答下列问题:
①根据上述提供的热化学方程式计算,36g水由液态变成气态的热量变化是 。
②写出C(s,石墨)与水蒸气反应的热化学方程式 。
③丙烷是液化石油气的主要成分之一,丙烷燃烧的热化学方程式为:
C3H8(g)+5O2(g) 3CO2(g)+4H2O(g)△H=-2220.0kJ?mol-1
相同物质的量的丙烷和一氧化碳完全燃烧生成气态产物时,产生的热量之比为___,相同质量的氢气和丙烷完全燃烧生成气态产物时,产生的热量之比为 。
查看答案和解析>>
科目: 来源: 题型:
(08山东海阳一中模拟)盖斯定律认为:不管化学过程是一步完成或分为数步完成,这个过程的热效应是相同的。已知:
H2O(g)=H2O(l) △H1=-Q1kJ?mol-1
C2H5OH(g)=C2H5OH(l) △H2=-Q2kJ?mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3kJ?mol-1
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量为(KJ) ( )
A.Q1+O2+Q3 B.0.5(Q1+Q2++Q3 )
C.0.5 Q1-1.5O2+0.5Q3 D.1.5 Q1-0.5O2+0.5Q3
查看答案和解析>>
科目: 来源: 题型:
(08山东实验中学诊断)强酸和强碱在稀溶液里反应的热化学方程式可表示为:
H+(aq)+OH-(aq)=H2O(l); △H= -57.3 kJ?mol -1
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l) ;△H= -Q1 kJ?mol-1
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l) ; △H= -Q2kJ?mol-1
上述均系在溶液中进行的反应,Q1、Q2的关系正确的是 ( )
A.Q1=Q2=57.3 B.Q1>Q2>57.3
C.Q1<Q2=57.3 D.无法确定
查看答案和解析>>
科目: 来源: 题型:
(08山东实验中学三模)用CH4催化还原NOX可以消除氮氧化物的污染例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
下列说法不正确的是( )
A.由反应①可推知:CH4(g)+4NO2(g)-4NO(g)+CO2(g)+2H2O(1);△H=-Q?Q>574kJ?mol-1
B.等物质的量的甲烷分别参加反应①②,则反应转移的电子数不同
C.若用标准状况下4.48LCH4还原NO2至N2,放出的热量为173.4kJ
D.若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为160mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com