
科目: 来源: 题型:
14C常用于测定生物遗骸的年份。下列说法正确的是
A.14C含有14个中子 B.14C与14N含有相同的质子数
C.14C与C60互为同位素 D.14C与12C是两种不同的核素
查看答案和解析>>
科目: 来源: 题型:
将n mol的木炭粉和1mol氧化亚铁在反应器中混合,隔绝空气加强热。
(1)可能发生的化学反应有:
①FeO+C → Fe+CO ↑ ② C+CO2 → 2CO
③FeO+CO → Fe+CO2↑ ④的反应是______________________.
(2)若n<1/4,充分反应后,反应容器中的固体物质是____________,气体产物是______。
(3)若n>4,充分反应后,反应容器中的固体物质是____________,气体产物是______。
(4)若反应的气体产物是混合物,n的取值范围是_____________________。
(5)若反应的气体产物是混合物,且混合物CO和CO2的物质的量相等,则n的值为___________。
查看答案和解析>>
科目: 来源: 题型:
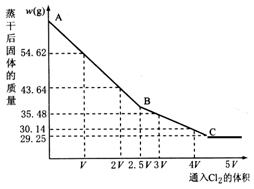
取一定量的NaBr、NaI的混合物平均分成五等份,加水配成溶液,再分别通入一定体积的氯气。将反应后的溶液蒸干、灼烧,将得到的固体冷却后称量,记录所得的数据绘制成如下图所示的曲线,回答下列问题。
(1)通入2V L Cl2的溶液中发生反应的离子方程式为:______________。
(2)五等份中每一等份混合物中NaBr与NaI的物质的量之和为_________mol。
(3)标准状况下,V=___________L。
(4)原混合物中NaBr与NaI的物质的量为之比为_____________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | --- |
I.(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金. 理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理: ( 填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 ,反应的离子方程式为 。
(3)实验室溶解该熔融物,下列试剂中最好的是 (填序号),并说明理由:_____________________________________________________.
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
II.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度 越稀,对应还原产物中氮元素的化合价越低。为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
越稀,对应还原产物中氮元素的化合价越低。为了测定熔融物中两种金属的物质的量之比,某同学取一定量上述的熔融物与足量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
(1)逐滴加入4mol/L的氢氧化钠溶液的定量玻璃仪器 图中OC段没有沉淀生成的原因是:__________________________.(用离子方程式表示)
(2)由上述图形分析可知,溶液中结合OH-能力最强的离子是_______(填离子符号,下同)、最弱的离子是 。若测定F点沉淀的质量,需对混合物进行:过滤、 、 、称量。
(3)通过上图数据试计算,熔融物中两种金属的物质的量之比n(Fe):n(Al)= 。
查看答案和解析>>
科目: 来源: 题型:
我国有丰富的天然气资源。以天然气为原料合成尿素的主要步骤如下图所示(图中某些转化步骤及生成物未列出):
| |
|
请填写下列空白:
(1)已知0.5 mol甲烷和0.5 mol水蒸气在t ℃,p k Pa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量。该反应的热化学方程式是: 。
(2)上述流程中,工业上分离H2 、CO2合理的方法是___________。
A.混合气先通入氢氧化钠溶液,再在溶液中加盐酸
B.混合气加压冷却,使CO2液化
C.混合气用氨水洗涤
D.混合气先通入到石灰浆,然后高温煅烧固体,
(3)为了保证氨气顺利合成,在空气进入合成塔之前必须对空气进行___________,目的是________________________________________;在合成氨的实际生产过程中,常采取将生的氨从混合气体中分离出来,分离出氨的方法: ;
(4)常采取将生成的氨从混合气体中分离出来;以及将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气。请在上图中用箭头线画出氮气和氢气循环利用。
并请应用化学反应速率和化学平衡的观点说明采取该措施的理由:
;
。
(5)第一次合成尿素在化学发展史上具有深刻的意义,突破了有机物只能从有机体提炼,首次由无机物得到有机物。它是由氰酸铵(NH4CNO)在一定条件下反应而得。请写出历史上合成尿素的化学方程式:
查看答案和解析>>
科目: 来源: 题型:
下图表示373K时,反应A(g) ![]() 2B(g) 在前110s内的反应进程(将该反应看作匀速进行)
2B(g) 在前110s内的反应进程(将该反应看作匀速进行)

(1)写出该反应的化学平衡常数表达式K=_____________________
T(K) | 273 | 323 | 373 |
K | 0.0005 | 0.022 | 0.36 |
(2)A(g) ![]() 2B(g)在不同温度下的K值见上表,则该反应的逆反应为_________反应(填“放热”或“吸热”)。从开始至第一次达到平衡过程中,用B表示反应平均速率为_______。
2B(g)在不同温度下的K值见上表,则该反应的逆反应为_________反应(填“放热”或“吸热”)。从开始至第一次达到平衡过程中,用B表示反应平均速率为_______。
(3)温度升高,B的转化率_____________(填“增大”、“减小”、或“不变“,下同),B的反应速率___________。
(4)373K时,将A气体放入一密闭容器内进行反应。根据图判断:90~100s时,曲线变化的原因是(文字表达式)____________________________________。反应进行至70s时,改变的条件可能是___________(填编号)。
A . 加入负催化剂 B. 扩大容器体积 C. 升高温度 D .增加A的浓度
查看答案和解析>>
科目: 来源: 题型:
已知酸性高锰酸钾溶液可以氧化亚铁离子和草酸根离子,其离子反应式为:
MnO4- + C2O42- + H+ → CO2↑+ Mn2+ + H2O
现称取草酸亚铁[FeC2O4]样品2.00 g(其中的杂质不跟高锰酸钾和硫酸反应),再将其溶于稀硫酸,然后用0.200 mol?L-1的酸性高锰酸钾溶液滴定,达到终点时消耗了33.4 mL酸性高锰酸钾溶液。
(1) 请写出MnO4-和Fe2+反应的离子方程式(反应物与生成物分别填入以下空格内)。
MnO4- + Fe2+ + → + + 。
(2)反应中,被还原的元素是 ,还原剂是 。
(3)将高锰酸钾氧化 C2O42- 反应中的氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。
![]()
(4)求样品中草酸亚铁的质量分数
查看答案和解析>>
科目: 来源: 题型:
四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题:
元素符号 | 元素性质或结构信息 |
A | 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一 |
B | 原子半径是短周期主族元素中最大的 |
C | 地壳中含量最多的金属元素 |
D | 原子核外有五种不同能量的电子,且最外层有2个未成对电子 |
(1)写出A原子核外电子排布的轨道表示式 ;B原子的电子排布式为
(2)写出A形成气态氢化物的电子式 ,实验室检验该气体的方法是 。
(3)对于D元素的单质或化合物叙述一定正确的是( )
A.单质不溶于任何溶剂
B.其最高价氧化物的水化物为弱酸
C.其最高价氧化物的晶体为分子晶体
D.气态氢化物不稳定
(4)B、C两元素金属性较强的是 (写元素符号),写出证明这一结论的一个实验事实查看答案和解析>>
科目: 来源: 题型:
(08山东卷)(14分)黄铜矿(CuFeS2)是制取铜及其化合物的主要原料之一,还可以制备硫及铁的化合物。
⑴冶炼铜的反应为
8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2
若CuFeS2中Fe的化合价为+2,反应中被还原的元素是 (填元素符号)。
⑵上述冶炼过程产生大量SO2。下列处理方案中合理的是 (填代号)。
a.高空排放
b.用于制备硫酸
c.用纯碱溶液吸收制Na2SO4
d.用浓硫酸吸收
⑶过二硫酸钾(K2S2O8)具有强氧化性,可将I-氧化为I2:
S2O82-+2I-=2SO42-+I2
通过改变反应途径,Fe3+、Fe2+均可催化上述反应。试用离子方程式表示Fe3+对上述反应催化的过程。
、 (不必配平)
⑷利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3。方法为
①用稀盐酸浸取炉渣,过滤。
②滤液先氧化,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。
a.除去Al3+的离子方程式是 。
b.选用提供的试剂,设计实验验证炉渣中含有FeO。
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水
所选试剂为 。
证明炉渣中含有FeO的实验现象为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com