
科目: 来源: 题型:
一种聚合物锂电池的电池总反应为:![]() 。电池内的高分子聚合物能让Li+自由通过。下列说法正确的是
。电池内的高分子聚合物能让Li+自由通过。下列说法正确的是
![]() A.电池放电时,正极反应为:LixC6=xLi+6C+xe-
A.电池放电时,正极反应为:LixC6=xLi+6C+xe-
![]() B.放电时,Li+向负极移动
B.放电时,Li+向负极移动
![]() C.充电时,电极Li1-xCoO2与电源正极相连
C.充电时,电极Li1-xCoO2与电源正极相连
![]() D.用此电池电解食盐水,生成4gNaOH,负极材料质量会减少0.7g
D.用此电池电解食盐水,生成4gNaOH,负极材料质量会减少0.7g
查看答案和解析>>
科目: 来源: 题型:
(07年海南卷)通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是_____ ;
(2)X与金属钠反应放出氢气,反应的化学方程式是 ______ (有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是 _____ ;
(4)X与高锰酸钾酸性溶液反应可生成Z。在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W,若184gX和120gZ反应能生成106gW,计算该反应的产率。(要求写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
(07年海南卷)(9分)依据氧化还原反应: 2Ag+(aq) + Cu(s) == Cu2+(aq) + 2Ag(s) 设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是______ ;电解质溶液Y是______ ;
(2)银电极为电池的 _____ 极,发生的电极反应为 ______ ;
X电极上发生的电极反应为 ______ ;
(3)外电路中的电子是从_____ 电极流向 ____ 电极。
查看答案和解析>>
科目: 来源: 题型:
一定条件下在固定容积的密闭容器中充入a molO2和b mol SO2发生反应: ![]() 。反应过程中物质的浓度变化如图所示。下列有关判断正确的是
。反应过程中物质的浓度变化如图所示。下列有关判断正确的是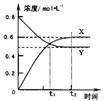
A.Y线是表示SO2的浓度变化
B.反应在t1时刻达到平衡状态
C.平衡状态时,容器中气体密度不再改变
D.再往该容器中充入a molO2和b mol SO2,该条件下重新达到平衡时,c(SO3)>1.2mol/L
查看答案和解析>>
科目: 来源: 题型:
(07年海南卷)(10分)下表为元素周期表的一部分,请回答有关问题:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 |
|
|
|
| ① |
| ② |
|
3 |
| ③ | ④ | ⑤ |
| ⑥ | ⑦ | ⑧ |
4 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)⑤和⑧的元素符号是____ 和_____ ;
(2)表中最活泼的金属是_____ ,非金属最强的元素是____ ;(填写元素符号)
(3)表中能形成两性氢氧化物的元素是_____ ,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:
________ ,__________ ;
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:______________ 。
查看答案和解析>>
科目: 来源: 题型:
如图是一种综合处理SO2废气的工艺流程。若每步反应都完全,下列说法正确的是

A.溶液B中发生的反应为:2SO2+O2=2SO3
B.假设反应过程中溶液的体积不变,溶液A、B、C的pH:A>B>C
C.由以上过程可推知氧化性:O2>Fe2+>SO42-
D.此工艺优点之一是物质能循环使用
查看答案和解析>>
科目: 来源: 题型:
(07年海南卷)有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl―离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol?L-1为()
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
查看答案和解析>>
科目: 来源: 题型:
设阿伏伽德罗常数(NA)的数值为nA,下列说法正确的是
A.常温常压下,2.8g乙烯和丙烯的混合物中所含原子总数为0.2nA
B.1mol甲基所含电子总数为7nA
C.1L0.2mol/L的硫酸铁溶液中所含铁离子总数为0.4 nA
D.用含0.32mol H2SO4的浓硫酸跟足量铜反应,转移的电子数为0.2 nA
查看答案和解析>>
科目: 来源: 题型:
进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习方法之一。下列实验推理中,正确的是
A.将镁和铝用导线连接再插进稀NaOH溶液中,镁条上产生气泡,说明镁比铝活泼
B.在溴水中通入SO2气体,溴水褪色,说明SO2有漂白性
C.将铜片放入浓硫酸中,无明显现象,说明铜在冷的浓硫酸中发生钝化
D.某溶液用盐酸酸化,无现象,再滴加氯化钡溶液,有白色沉淀产生,说明溶液中有SO42-
查看答案和解析>>
科目: 来源: 题型:
(07年海南卷)有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl―离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol?L-1为()
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com