
科目: 来源: 题型:
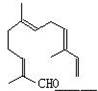
现在试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2, 能与该化合物中所有官能团都发生反应的试剂有()
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目: 来源: 题型:
食品安全关系到国计民生,备受关注。
Ⅰ、山梨酸(CH3CH=CHCH=CHCOOH)是高效安全的食品防腐剂。
(1)下列关于山梨酸性质叙述不正确的是__________
A.能与溴水发生加成反应 B.能使酸性高锰酸钾褪色
C.碱性条件系能水解 D.能发生加聚反应
(2)山梨酸还可以合成类似于天然橡胶的高分子材料,合成路线如下:

写出①的反应方程式:________________________;②的反应类型:_________
Ⅱ、三鹿奶粉添加三聚氰胺致死婴儿重大事故令人震惊。请回答下列问题:
(1)奶粉中蛋白质平均含氮量为16%,三聚氰胺中氮的质量分数为______
(2)三聚氰胺在人体内发生取代反应(水解),生成三聚氰酸(下图),

写出三聚氰胺水解方程式______________________
(3)不法企业在原奶中添加尿素CO(NH2)2,高温下可以生成三聚氰胺和NH3、CO2,奶粉中不含尿素了,但是含氮量仍然较高。写出尿素高温产生三聚氰胺的化学方程式________
查看答案和解析>>
科目: 来源: 题型:
甲醇合成反应为:![]() 工业上用天然气为原料,分为两阶段:
工业上用天然气为原料,分为两阶段:
 Ⅰ、制备合成气:
Ⅰ、制备合成气:![]() 。为解决合成气中H2过量CO不足问题,原料气中添加CO2:
。为解决合成气中H2过量CO不足问题,原料气中添加CO2:![]() 。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________
。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为_________
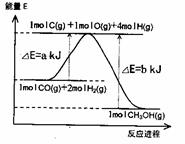
Ⅱ、合成甲醇:(1)反应过程中物质能量变化如右图所示。
写出合成甲醇的热化学方程式_________________。
![]()
实验室在1L密闭容器中进行模拟合成实验。将1molCO和2molH2通入容器中,分别恒温在300℃和500℃ 反应,每隔一定时间测得容器中甲醇的浓度如下:![]()
![]()
| 10min | 20min | 30min | 40min | 50min | 60min |
300℃ | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500℃ | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
(2)在300℃ 反应开始10分钟内,H2的平均反应速率_____________
(3)500℃ 平衡常数K=___________
(4)在另一体积不变的容器中,充入1.2molCO2和2.0molH2,一定条件下达到平衡,测得容器内压强为起始的一半。计算该条件下H2转化率。(写出计算过程)
查看答案和解析>>
科目: 来源: 题型:
(07年海南卷)(9分)下表是稀硫酸与某金属反应的实验数据:
实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol?L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
反应前 | 反应后 | ||||||
1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, 对反应速率有影响, 反应速率越快,能表明同一规律的实验还有 (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有 (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ,其实验序号是 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因是_______。
查看答案和解析>>
科目: 来源: 题型:
氯碱厂废渣(盐泥)中含有镁钙铁铝的硅酸盐和碳酸盐,其中含镁(以MgO计)约10%,钙(以CaO计)约15%,铁(Ⅱ、Ⅲ)和铝等的含量低于1%。氯碱厂从盐泥中提取MgSO4.7H2O的流程如下:
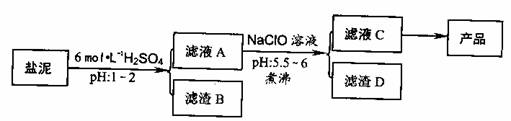
部分阳离子以氢氧化物沉淀时溶液pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
pH | 5.2 | 3.2 | 9.7 | 11.2 |
溶解度表
温度0C | 10 | 30 | 40 |
CaSO4 | 0.19 | 0.21 | 0.21 |
回答下列问题:
(1)滤渣B的主要成分是:__________________
 (2)从滤渣A得到滤液C,能否用氨水代替NaClO?_________,说明理由________,其中加热煮沸的目的是_________________
(2)从滤渣A得到滤液C,能否用氨水代替NaClO?_________,说明理由________,其中加热煮沸的目的是_________________
(3)从滤液C中获得产品经过3个操作步骤,分别是________,________,_______
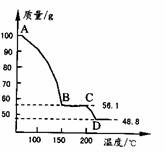
(4)将一定质量的MgSO4.7H2O放在坩埚中加热测得不同温度阶段剩余固体质量如右图所示。据图写出CD段反应的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
对钢铁零件进行表面发蓝处理可大大增强抗蚀能力。其主要工艺如下:
(1)预处理:把钢铁零件分别浸入105℃的1.0mol/L Na2CO3溶液→20℃水→20℃30%盐酸→20℃水。其中酸浸的目的是 。
![]() (2)氧化发蓝处理:把预处理后钢铁零件浸入140℃1L发蓝液中(15.6mol/LNaOH、3.26mol/LNaNO2),发生如下反应:
(2)氧化发蓝处理:把预处理后钢铁零件浸入140℃1L发蓝液中(15.6mol/LNaOH、3.26mol/LNaNO2),发生如下反应:
3Fe+NaNO2+5NaOH=3Na2FeO2+NH3+H2O;
3Na2FeO2+ NaNO2+5H2O =3Na2Fe2O4+NH3+7NaOH
Na2FeO2+ Na2Fe2O4+2H2O= Fe3O4+4NaOH
总反应可以表示为____________。测得发蓝处理残留液NaOH浓度为16.0mol.L-1,则反应中转移电子为________mol(假设体积不变)
(3)氧化膜致密性检查:①浓硝酸、硫酸、③氯水、④硫酸铜溶液、⑤KSCN溶液、⑥NaOH溶液。请选用上述合适试剂设计方案,检查发蓝零件的氧化膜致密性是否合格。填写下表:
实验步骤 | 现象 | 结论 |
|
| 产品不合格 |
(4)发蓝液废水中含有致癌物NaNO2,可以用氧化剂如漂白粉转变成硝酸钠,写出离子方程式:_________________
查看答案和解析>>
科目: 来源: 题型:
(07年海南卷)(9分)下表是稀硫酸与某金属反应的实验数据:
实验序号 | 金属 质量/g | 金属状态 | C(H2SO4) /mol?L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/s | |
反应前 | 反应后 | ||||||
1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明, ______ 对反应速率有影响,______ 反应速率越快,能表明同一规律的实验还有 _____ (填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有_____ (填实验序号);
(3)本实验中影响反应速率的其他因素还有 ____ ,其实验序号是_____ 。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: _________ 。
查看答案和解析>>
科目: 来源: 题型:
化学探究小组用H2C2O4(草酸)溶液测定KMnO4溶液的浓度。请回答下列问题:
Ⅰ、取20.00mL0.250mol/L H2C2O4标准溶液置于锥形瓶中,加入适量稀硫酸酸化,用KMnO4溶液进行滴定。滴定反应方程式为(未配平):
![]()
记录数据如下:
滴定次数 | 标准溶液体积/mL | 待测溶液体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 1.50 | 23.70 |
2 | 20.00 | 1.02 | 21.03 |
3 | 20.00 | 2.00 | 21.99 |
(1)滴定时,KMnO4溶液应装在______滴定管中(选填:酸式、碱式)。
(2)滴定终点的判断方法是: 。
(3)根据上述数据计算,该KMnO4溶液的浓度为 mol/L
(4)下列操作中使得KMnO4溶液浓度偏低的是 。
A.滴定管用水洗净后直接注入KMnO4溶液
B.滴定前盛放标准H2C2O4溶液的锥形瓶用蒸馏水洗净后没有干燥
C.滴定管内在滴定前有气泡,滴定后气泡消失
D.读取KMnO4溶液体积时,滴定前平视,滴定结束后俯视读数
Ⅱ、滴定中发现,KMnO4紫红色褪去的速度开始时很慢、后来变快、最后又变慢。为研究由慢到快的原因,甲同学继续进行了下列实验,实验数据如下表:
编号 | 温度/℃ | 酸化的H2C2O4溶液/mL | KMnO4溶液/mL | 溶液褪色时间/s |
1 | 25 | 5.0 | 2.0 | 40 |
2 | 25 | 5.0(另外加少量MnSO4粉末) | 2.0 | 4 |
3 | 60 | 5.0 | 2.0 | 25 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com