
科目: 来源: 题型:
(08年北京卷) X、Y均为元素周期表中前20号元素,其简单离子的电子层结构相同,下列说法正确的是()
A.由mXa+与nYb-,得m+a=n-b
B.X2-的还原性一定大于Y-
C.X,Y一定不是同周期元素
D.若X的原子半径大于Y,则气态氢化物的稳定性HmX一定大于HnY
查看答案和解析>>
科目: 来源: 题型:
(07年四川卷)NA代表阿伏加德罗常数,下列说法正确的是()
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L0.5mol/LNa2CO3 溶液中含有的CO32-数目为0.5NA
查看答案和解析>>
科目: 来源: 题型:
目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大潜力。
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于 晶体;基态Ni原子的电子排布式为 。
(2)配合物 分子内的作用力有 (填编号)。
分子内的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH≡CH、③![]() 、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO分子的立体结构
、④HCHO等,其中碳原子采取sp2杂化的分子有 (填物质序号),预测HCHO分子的立体结构 为 形。
为 形。
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。该合金的晶胞如右图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点。该晶体的化学式 。
查看答案和解析>>
科目: 来源: 题型:
某有机物X(C11H9O6Br)分子中有多种官能团,其结构简式为:

(其中Ⅰ、Ⅱ为未知部分的结构),为推测X的分子结构,进行如下转化

已知向D的水溶液中滴入FeCl3溶液发生显色反应,滴入NaHCO3溶液有无色无味气体产生,且D苯环上的一氯代物有两种。
(1)D中的官能团名称: ;X的结构简式:
(2)写出E→F的化学方程式:
(3)D可能发生的反应有:
A.加成反应 B.消去反应 C.取代反应 D.氧化反应 E.加聚反应
(4)D有多种同分异构体,遇FeCl3溶液发生显色反应,又能发生银镜反应,其中能水解的同分异构体的结构简式为: ,不能水解的同分异构体的结构简式为: (各写出一种)
查看答案和解析>>
科目: 来源: 题型:
咖啡酸苯乙酯 是一种天然抗癌药物,在一定条件下能发生如下转化:
是一种天然抗癌药物,在一定条件下能发生如下转化:

请填写下列空白。
(1).D分子中的官能团是________。
(2).高分子M的结构简式是______________。
(3).写出A→B反应的化学方程式:___________________。
(4).B→C发生的反应类型有______________。
(5).A的同分异构体很多种,其中,同时符合下列条件的同分异构体有____种。
①苯环上只有两个取代基;
②能发生银镜反应;
③能与碳酸氢钠溶液反应;
④能与氯化铁溶液发生显色反应。
查看答案和解析>>
科目: 来源: 题型:
(07年四川卷)NA代表阿伏加德罗常数,下列说法正确的是()
A.标准状况下,22.4LCHCl3中含有氯原子数目为3NA
B.7gCnH2n中含有的氢原子数目为NA
C.18 g D2O中含有的质子数目为10NA
D.1 L 0.5 mol?L-1Na2CO3 溶液中含有的CO32-数目为0.5NA
查看答案和解析>>
科目: 来源: 题型:
将2 mol SO2和1 mol O2混合置于体积可变的密闭容器中,在T1温度下发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g) △H<0
2SO3(g) △H<0
当反应进行到时间t0点时达到平衡状态,测得混合气体的总物质的量为2.1 mol。试回答:
(1)该反应的平衡常数表达式为 。
(2)反应进行到t0时SO2的体积分数为 。
(3)保持温度不变,若使用催化剂,在图中作出从反应开始到t0点这段时间SO2物质的量变化曲线。
(4)当反应进行到t1时间时(t1>t0),给上述反应容器加热到温度T2 (T2>T1),反应在t2 时间时(t2>t1)重新达到平衡状 态,这时K值 (填“增大”“减小”或“不变”),新平衡混合物中气体的总物质的量 ______2.1 mol(填“<”、“>”或“=”)。
查看答案和解析>>
科目: 来源: 题型:
(08年北京卷)下列各组物质的无色溶液,不用其它试剂即可鉴别的是()
①KOH Na2SO4 AlCl3 ②NaHCO3 Ba(OH)2 H2SO4
③HCl NaAlO2 ④Ca(OH)2 Na2CO3 BaCl2
A.①② B.②③ C.①③④ D.①②④
查看答案和解析>>
科目: 来源: 题型:
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行如下实验探究。
[实验一]为测定硫元素的含量
Ⅰ.将m1 g该黄铁矿样品放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2

Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理:

问题讨论:
⑴.Ⅰ中,甲瓶内所盛试剂是________溶液。乙瓶内发生反应的离子方程式有_________________、_________________。
⑵.Ⅱ中,所加H2O2溶液(氧化剂)需足量的理由是_____________。
⑶.该黄铁矿中硫元素的质量分数为______________。
[实验二]设计以下实验方案测定铁元素的含量

问题讨论:
⑷.③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有__________。
⑸.②中,若选用铁粉作还原剂,你认为合理吗?理由是:____________。查看答案和解析>>
科目: 来源: 题型:阅读理解
近年来,江苏省酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
⑴有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,流程如下: ( I )将含SO2的废气通入电解饱和食盐水所得溶液中,得NaHSO3溶液。(Ⅱ)将电解饱和食盐水所得气体反应后制得盐酸。(III)将盐酸加入NaHSO3溶液中得SO2气体回收,生成的NaCl循环利用。
① 写出步骤(I)反应的化学方程式:
② 写出步骤(III)反应的离子方程式:
⑵ 还有学者提出利用 Fe 2十、Fe3十等离子的催化作用,常温下将SO2氧化成SO42一而实现SO2的回收利用。某研究性学习小组据此设计了如下方案,在实验室条件下测定转化器中SO2氧化成SO42一的转化率。

① 该小组采用下图装置在实验室测定模拟烟气中SO2的体积分数,X溶液可以是(填序号) 。
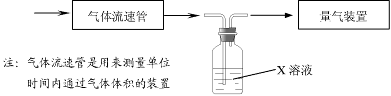
A.碘的淀粉溶液 B.酸性高锰酸钾溶液 C.氢氧化钠溶液 D.氯化钡溶液
② 若上述实验是在标准状况下进行的,X是已知体积和物质的量浓度的溶液,欲测定转化器中SO2氧化成SO42-的转化率,已知气体流速,还需测定的数据是
(3)新型氨法烟气脱硫技术采用氨吸收烟气中SO2生成亚硫酸铵和亚硫酸氢铵,再用一定量的磷酸进行反应,在反应回收SO2后的混合物中通入适量的氨气得到一种产品。该技术的优点是 。
(4)为进一步减少SO2的污染并变废为宝,人们正在探索用CO还原SO2得到单质硫的方法来除去SO2。该方法涉及到的化学反应为:SO2+2CO=2CO2+![]() Sx 、CO+
Sx 、CO+![]() Sx=COS、2COS+SO2=2CO2+
Sx=COS、2COS+SO2=2CO2+![]() Sx 。其中COS中“C”化合价为 。
Sx 。其中COS中“C”化合价为 。
(5)若生活污水中含大量的氮化合物,通常用生物膜脱氮工艺进行处理:首先在消化细菌的作用下将NH4+氧化为NO3-:NH4++2O2=NO3-+2H++H2O,然后加入甲醇,NO3-和甲醇转化为两种无毒气体。请写出加入甲醇后反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com