
科目: 来源: 题型:
(07年广东卷)(10分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:

氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl g。
(2)实验室进行蒸发浓缩用到的主要仪器有 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是 。

查看答案和解析>>
科目: 来源: 题型:
已知:H+(aq) + OH-(aq) =H2O(l) ;△H=-57.3 kJ/mol。对于下列反应:
①HCl(aq) + NH3?H2O(aq)= NH4Cl(aq) + H2O(l) ;△H=-a kJ/mol
②HCl(aq) + NaOH(s) = NaCl(aq) + H2O(l) ;△H=-b kJ/mol
③HNO3(aq) + KOH(aq) = KNO3(aq) + H2O(l) ;△H=-c kJ/mol
则a、b、c三者的大小关系为
A.a>b>c B.b>c>a C.a=b=c D.无法比较
查看答案和解析>>
科目: 来源: 题型:
化学平衡常数(K)、电离常数(Ka)、溶度积常数(KSP)是判断物质性质或变化的重要的常数。下列关于这些常数的说法中,正确的是
A.化学平衡常数的大小与温度、浓度、压强、催化剂有关
B.当温度升高时,弱酸的电离常数Ka变小
C.KSP(AgCl)>KSP(AgI)由此可以判断![]() 能够发生
能够发生
D.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
查看答案和解析>>
科目: 来源: 题型:
下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是
①金属钠投入FeCl3溶液中 ②过量的NaOH溶液和明矾溶液 ③Na2S2O3溶液与稀硫酸 ④ Na2O2投入FeCl2溶液中 ⑤浓硫酸铵溶液加入到浓氢氧化钠中 ⑥Al2(SO4)3与Na2SiO3溶液
A.①②④ B.③④⑤ C.①③④⑥ D.①③④
查看答案和解析>>
科目: 来源: 题型:
木质素是制浆造纸工业的副产物,具有优良的物理化学特点,木质素的一种单体结构简式如右图所示。下列说法错误的是 
A.该物质的分子式是C10H12O3,不属于芳香烃
B.每摩尔该物质最多能消耗4mol H2
C.遇FeCl3溶液呈血红色
D.该物质能发生酯化反应
查看答案和解析>>
科目: 来源: 题型:
在pH为4~5的环境中,Cu2+、Fe2+不生成沉淀,而Fe3+几乎完全沉淀.工业上制![]() 是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
是将浓盐酸用蒸汽加热到80℃左右,再慢慢加入粗氧化铜(含杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是
A.加入纯Cu将Fe2+还原
B.在溶液中通入Cl2,再加入CuO粉末调节pH为4~5
C.向溶液中通入H2S使Fe2+沉淀
D.在溶液中通入Cl2,再通入NH3调节pH为4~5
查看答案和解析>>
科目: 来源: 题型:
(08年海南卷)设NA为阿伏加德罗常数,下列说法正确的是()
A.标准状况下,5.6L四氯化碳含有的分子数为0.25NA
B.标准状况下,14g氮气含有的核外电子数为5NA
C.标准状况下,22.4L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.标准状况下,铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
查看答案和解析>>
科目: 来源: 题型:
下列有关新闻事件的叙述正确的是w.w.w.k.s.5.u.c.o.m
A.在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化
B.我国决定推广使用车用乙醇汽油,乙醇汽油是一种新型的化合物,属于可再生能源
C.制造航空服的“连续纤维增韧”材料主要成分由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料
D.“绿色荧光蛋白质”是由氨基酸加聚而成的高分子化合物
查看答案和解析>>
科目: 来源: 题型:
(07年广东卷)(10分)以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,工艺流程如下:

氯化铵和硫酸钠的溶解度随温度变化如上图所示。回答下列问题:
(1)欲制备10.7gNH4Cl,理论上需NaCl _____ g。
(2)实验室进行蒸发浓缩用到的主要仪器有______ 、烧杯、玻璃棒、酒精灯等。
(3)“冷却结晶”过程中,析出NH4Cl晶体的合适温度为____ 。
(4)不用其它试剂,检查NH4Cl产品是否纯净的方法及操作是_____ 。
(5)若NH4Cl产品中含有硫酸钠杂质,进一步提纯产品的方法是_____ 。
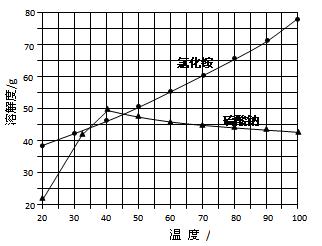
查看答案和解析>>
科目: 来源: 题型:阅读理解
(12分) 某化学研究性学习小组拟测定食醋的总酸量(g/100mL),请你参与该小组的实验并回答相关问题。
【实验目的】测定食醋的总酸量
【实验原理】中和滴定
【实验用品】蒸馏水,市售食用白醋样品500mL(商标注明总酸量:3.50g/100mL~5.00g /100mL),0.1000mol/LNaOH标准溶液;100mL容量瓶,10ml移液管,碱式滴定管,铁架台,滴定管夹,锥形瓶,烧杯,酸碱指示剂(可供选用的有:甲基橙,酚酞,石蕊)。
【实验步骤】
① 配制并移取待测食醋溶液
用10mL移液管吸取10mL市售白醋样品置于100mL容量瓶中,用处理过的蒸馏水稀释至刻度线,摇匀后用酸式滴定管取待测食醋溶液20mL,并移至锥形瓶中。
② 盛装标准NaOH溶液
将碱式滴定管洗净后,用NaOH标准溶液润洗3次,然后加入NaOH标准溶液,排除尖嘴部分气泡后,使液面位于“0”刻度或“0”度以下。静置,读取数据并记录为NaOH标准溶液体积的初读数。
③ 滴定
往盛有待测食醋溶液的锥形瓶中滴加某酸碱指示计2~3滴,滴定至终点。记录NaOH的终读数。重复滴定3次。
【数据记录】
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
V (NaOH)始/mL | 0.00 | 0.20 | 0.10 | 0.10 |
V (NaOH)终/mL | 14.98 | 15.20 | 15.12 | 16.24 |
问题与思考】
⑴ 步骤①中中还需补充的仪器有 。蒸馏水的处理方法是 。
⑵ 步骤③中你选择的酸碱指示剂是 ,理由是 。
⑶ 若用深色食醋进行实验,为准确判断滴定终点,可采取的措施是 。
⑷ 样品总酸量= g/100mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com