
科目: 来源: 题型:
向X的溶液中,加入Y试剂,产生的沉淀示意图如下图所示情形的是(注意线段的斜率)
 A.向NaOH和Ca(OH)2的混合液中通入
A.向NaOH和Ca(OH)2的混合液中通入
B.向HCl和AlCl3的混合液中滴加NaOH
C.向NH4Al(SO4)2溶液中滴加NaOH
D.向NH4Cl和MgCl2的混合液中滴加NaOH
查看答案和解析>>
科目: 来源: 题型:
将铝片和铜片用导线相连后分成两组,第一组插入浓硝酸中,第二组插入稀氢氧化钠溶液中分别形成了原电池,下列说法中正确的是
A.根据原电池的工作原理,相对活泼的金属作负极,所以两个原电池中的负极都是铝
B.两组电池分别工作一段时间后,电解质溶液的浓度都减小,电池的内阻增大,但溶液的pH都不变。
C.第一组原电池中负极的反应是:Cu 2e - =Cu2+
第二组原电池中正极的反应是:2H2O+2e - =H2↑+2OH -
D.两组电池工作时,溶液中的阴离子都向正极移动而阳离子都向负极移动。
查看答案和解析>>
科目: 来源: 题型:
关于生活中的有机物,下列说法不正确的是
A.工业酒精中含有甲醇,不能饮用
B.用油脂在碱性条件下的水解反应制取肥皂和甘油
C.食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
D.葡萄糖可以发生氧化反应、银镜反应和水解反应
查看答案和解析>>
科目: 来源: 题型:
(12分) Fridel―Crafts反应是向苯环上引入烷基最重要的方法,在合成上有很大的实用价值,该反应可以简单表示如下: ![]() ;△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇与盐酸反应制得叔丁基氯(沸点50.7℃),再利用Fridel―Crafts反应原理制备对叔丁基苯酚(熔点99℃)。反应流程及实验装置如下图所示:
;△H<0(Ar表示苯基)。某化学兴趣小组在实验室先利用叔丁醇与盐酸反应制得叔丁基氯(沸点50.7℃),再利用Fridel―Crafts反应原理制备对叔丁基苯酚(熔点99℃)。反应流程及实验装置如下图所示:

试回答下列问题:
(1)请写出本实验过程中的两个主要化学反应方程式: , 。
(2)有机层中加入饱和食盐水及饱和碳酸氢钠的作用可能是: 。
通过 操作可将叔丁基氯粗产物转化为较为纯净的叔丁基氯。
(3)若去掉该制备装置中的氯化钙干燥管,有可能导致的不良后果是(用化学方程式并配合文字说明): 。
(4)叔丁基氯与苯酚反应时适当控制温度是很重要的。若反应过程中温度过高应用冷水浴冷却,否则可能导致的不良后果是: 。
(5)常温下叔丁基氯易于发生消去反应故实验中所用的必须现用现配,试写出叔丁基氯发生消去反应反应的化学方程式: 。
(6)有时候最终产品对叔丁基苯酚不是白色而呈现紫色,你认为可能的原因是: 。
查看答案和解析>>
科目: 来源: 题型:
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同。
(1)第四周期过渡元素的明显特征是形成多种多样的配合物。
① CO可以和很多过渡金属形成配合物。CO分子中C原子上有一对孤对电子,C、O原子都符合8电子稳定结构,CO中中心原子的杂化类型为 杂化,与CO互为等电子体的分子和离子有(各写一种): 、 。
② Fe(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于 (填晶体类型)。
③ Ni(CO)6为正八面体结构,镍原子位于正八面体的中心,配位体CO在正八面体的六个顶点上。若把其中两个CO配位体换成 NH3 ,得到新的配合物有 种
④ 配合物 分子内的作用力有 (填编号)。
分子内的作用力有 (填编号)。
A.氢键 B.离子键 C.共价键 D.配位键
(2)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的。
 ⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
⑤ 镓原子的基态电子排布式是 。比较第一电离能Ga Zn(填 “>”、“=”、“<”),说明理由
(3)铜是是第四周期最重要的过渡元素之一,其单质及化合物具有广泛用途。
⑥ CuH的晶体结构如图所示,该晶体中Cu+的配位数为 。CuH具有许多特殊性质,如易分解、能与水反应、在氯气中燃烧等。写出CuH在氯气中燃烧的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
(10分)中学化学教材上有如下介绍:在氢氧化钠浓溶液中加入氧化钙,加热,制成的白色固体就是碱石灰。试根据题目的要求,回答下列问题:
(1)这种碱石灰中,除NaOH外还可能含有的物质是(可填满、可不填满也可补充)
情况1 | 情况2 | 情况3 | 情况4 | 情况5 |
|
|
|
|
|
(2)为探究这种碱石灰的组成,某校研究性学习小组(甲)设计的思路是:称取4.0g碱石灰配成500mL溶液,用pH计测溶液的pH,然后再通过 (填实验方法)测 (填物理量名称)即可推算出其组成的成分。
(3)研究性学习小组(乙)查得如下资料:氢氧化钙在250℃时不分解,氢氧化钠在580℃时不分解。他们设计了如下方案并得出相关数据:取该法制得的碱石灰4.0g,在250℃时加热至恒重,测得固体质量减少了0.6g,剩余固体在580℃时继续加热至恒重,固体质量又减少了0.7g 。请通过计算确定该碱石灰各成分的质量分数。
(4)为使该法制得的碱石灰所起的效果更好,除控制好NaOH与CaO的配比外,还需控制的实验条件是什么?
查看答案和解析>>
科目: 来源: 题型:
(12分) 已知:反应Ⅰ ![]()
反应Ⅱ ![]()
(R1、R2、R3、R4表示不同或相同烃基或氢原子)
现工业上利用某有机物A合成高分子J,其合成线路图如下:

请回答下列问题:
(1)D的结构简式为 ,反应⑥的反应类型为 。
(2)图中设计反应③、⑥的目的是 。
(3)A物质的同分异构体共有 种(不考虑顺反异构),其中一种同分异构体存在3种不同化学环境的氢原子,其键线式可表示为 ,A~G七种分子中有手性碳原子的是 。(填字母)
(4)![]() 在一定条件下发生加聚反应,所得到的高分子化合物的链节为 一定条件下反应⑧的化学方程式为 。
在一定条件下发生加聚反应,所得到的高分子化合物的链节为 一定条件下反应⑧的化学方程式为 。
(5)请设计从物质A制取![]() (用反应流程图表示并注明反应条件,无机试剂任选)。
(用反应流程图表示并注明反应条件,无机试剂任选)。
样例:合成反应流程图表示方法: ![]()
查看答案和解析>>
科目: 来源: 题型:
(10分) 地下水中硝酸根离子、亚硝酸根离子会造成地下水污染,目前地下水中硝酸根离子经济可行的脱氮方法是在合适的催化剂作用下,用还原剂(如HCOONa)将硝酸根离子还原为氮气而脱氮。
某化学研究性学习小组的同学在技术人员指导下,研究水样中硝酸根起始浓度为100 mg?L- 1条件下,用一定量的催化剂,以甲酸钠进行反硝化脱氮的效率及脱氮的最佳条件,实验中控制起始pH=4.5。经测定得到图1、图2及图3如下。
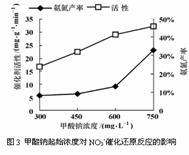


(1)地下水中硝酸盐可能来源于 ,地下水中硝酸盐含量的增大不仅影响人类和生物体的身体健康,还可能引起 等环境问题。(填一项)
(2)请写出用甲酸钠脱氮的主要离子方程式: 。
(3)分析图1,下列有关说法正确的是( )
A. NO2- 是反应过程中的中间产物
B.NH4+是反应中的一种副产物
C.反应30min后NO3-脱除速率降低,是因为硝酸根离子浓度降低
D.反应进行到75min时,溶液中含氧酸根离子脱除率最高
(4)由图2、图3分析,在本题实验条件下,用甲酸钠进行反硝化脱氮的合适条件:催化剂投入量为 ,甲酸钠起始浓度为 。
(5)根据图1计算,当反应进行至75min时,若NH4+浓度为3.8 mg?L-1,此时水样中氮的脱除效率为 %。(假设实验过程中溶液体积不变,结果保留两位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com