
科目: 来源: 题型:
(12分)通过火法冶金炼出的铜是粗铜,含杂质金、银、铁、锌,不适合电器及其他仪器使用,必须进行电解精炼。表1为几种物质的溶度积。
表1:几种物质的溶度积
物 质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
溶度积Ksp | 8.0×10-16 | 4.0×10-38 | 3×10-17 | 2.2×10-20 |
(1)在精炼铜时,阳极是 (填“纯铜板”或“粗铜板”);金、银失电子能力比铜弱,因此以单质的形式沉积在电解槽 (填“阳极”或“阴极”)的槽底,阴极电极反应方程式是 。
(2)在精炼铜的过程中,Cu2+浓度逐渐减少,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学设计了除杂方案(见下图)。
①试剂a是 ,加入试剂a的目的是 。
②操作①是 ,根据溶度积,除杂方案中能够除去的杂质金属阳离子是 。
③乙同学在查阅课本时发现,“工业原料氯化铵中含杂质氯化铁,使其溶解于水,再加入氨水调节PH至7~8,可使Fe3+生成Fe(OH)3沉淀而除去。”乙同学认为甲同学的除杂方案中也应该将溶液PH调至7~8。你认为乙同学的建议是否正确?(填“是”或“否”) ,
理由是 。
查看答案和解析>>
科目: 来源: 题型:
(10分)金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
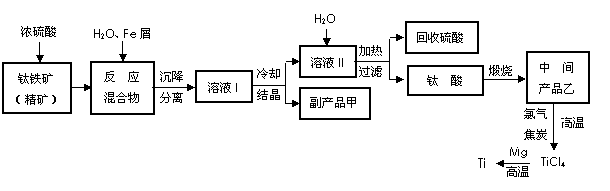
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
(2)上述生产流程中加入Fe屑的目的是 ,检验副产品甲是否变质的实验方法是 。
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入 溶解后除去。
(4)最近,用熔融法直接电解中间产品乙制取金属钛获得成功。写出电解乙制取金属钛的化学方程式 。
查看答案和解析>>
科目: 来源: 题型:
(12分)我国中医药已有数千年历史,其独特的疗效使得经深加工的中药产品正逐步进入国际市场,但国外在进口中药时对中药的重金属元素和有毒元素的含量等各项指标检查是非常严格的,因此把好出口中药的质量关是非常重要的。以下介绍了分析实验室对中草药中可能的残余有毒元素As的检验方法和步骤(As在中草药中主要以As2O3的形式存在):
①取1000g中草药样品进行前期处理制得待测溶液,此时样品中可能含有的As元素将转化为H3AsO3;
②将待测溶液转移入250mL锥形瓶中,并加入2-3滴0.2 %的淀粉溶液;
③用标准碘溶液滴定待测溶液至终点,消耗20.25mL标准I2溶液,其间发生反应:
H3AsO3+ I2+ H2O→H3AsO4+ I-+ H+(未配平)
试回答下列问题:
(1)简述如何对少量的中草药样品进行前期处理制得待测溶液?
。
(2)配平离子反应方程式:_ _H3AsO3+_ _I2+_ _H2O― _ _H3AsO4+_ _I-+_ _H+
(3)0.2%的淀粉溶液的作用是 ,如何判断滴定到达终点? 。
(4)题中所用标准碘溶液并非将碘单质直接溶解于蒸馏水中制得,而是由0.1070g纯KIO3、过量的KI以及酸混合,并将其准确稀释到1000 mL而制得,请用一个离子反应方程式说明标准碘溶液的形成过程 。
(5)我国《药用植物及制剂进出口绿色行业标准》中限定:绿色中药的砷含量不超过2.000mg/kg,试通过计算说明该中草药样品是否合格?(写出计算过程):______________
___________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(14分)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
(1)用pH试纸测定溶液的pH时,正确的操作是: 。
(2)简述强调“测得的pH小于7”的理由: 。
方案二:先在NaOH溶液中滴加几滴酚酞溶液,溶液显红色,然后再滴加盐酸,可观察到红色逐渐消失,则证明NaOH溶液与稀盐酸发生了化学反应。
该组同学在向NaOH溶液中滴加酚酞溶液时,发现了一个意外现象:氢氧化钠溶液中滴入酚酞溶液,溶液变成了红色,过了一会儿红色就消失了。该小组对这种意外现象的原因作了如下猜想:
①可能是酚酞溶液与空气中的氧气反应,使红色消失;
②可能是氢氧化钠溶液与空气中的二氧化碳反应,使红色消失。
(1)为验证猜想①,该组同学将配制的氢氧化钠溶液加热,并在液面上方滴一些植物油,然后在冷却后的溶液中滴入酚酞溶液。实验中“加热”和“滴入植物油”目的是 。实验结果表明酚酞溶液红色消失与空气中的氧气无关。
(2)为验证猜想②,该组同学做了如下实验:取了一定量的Na2CO3溶液,在其中滴入酚酞溶液,发现溶液也呈现红色。请用离子方程式解释这一现象产生的原因:
。
由此说明酚酞溶液红色消失与空气中的二氧化碳无关。
(3)该小组同学通过查阅资料得知:当氢氧化钠溶液浓度大于2mol/L时,就会出现上述意外现象。请设计实验证明该方案中取用的NaOH溶液浓度过大:
。
方案三:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。
该组同学将不同浓度的盐酸和NaOH溶液各10 mL混合,用温度计测定室温下混合前后温度的变化,并记录了每次混合前后温度的升高值△t(如下表)。
编号 | 盐酸 | NaOH溶液 | △t/℃ |
1 | 3.65 | 2.00 | 3.5 |
2 | 3.65 | 4.00 | x |
3 | 7.30 | 8.00 | 14 |

(1)表中x = 。
(2)某同学在没使用温度计的情况下,通过右图所示装置完成了实验。则该同学根据 (填实验现象)判断NaOH溶液与稀盐酸发生了中和反应。
查看答案和解析>>
科目: 来源: 题型:
(10分)已知Cu(OH)2沉淀在一定的条件下可以溶解在氨水中,有关反应的化学方程式为:

有下列实验操作:
(1)操作1:在盛有0.1mol/L、3mL的CuSO4溶液的试管中滴加0.2mol/L、3mL的NaOH溶液,结果出现蓝色的悬浊液,有关反应的离子方程式为 。
(2)操作2:在盛有0.1mol/L、3mL的CuSO4溶液的试管中滴加0.2mol/L、3mL的氨水,结果也出现蓝色的悬浊液,有关反应的离子方程式为 。
(3)在上述两种悬浊液中分别加入2mol/L的氨水溶解,请从平衡移动的角度思考哪一种悬浊液更易溶解成为澄清溶液? (填“操作1”或“操作2”),理由是
。
(4)请你设计一个简单的实验方案验证上述观点(或理由)的可靠性: 。
查看答案和解析>>
科目: 来源: 题型:
(10分)某活动课程小组拟用50mLNaOH溶液吸收CO2气体,制备Na2CO3溶液。为了防止通入过量的CO2气体生成NaHCO3,设计了如下实验步骤:
a.取25 mL NaOH溶液吸收过量的CO2气体,至CO2气体不再溶解;
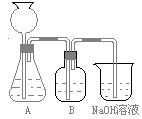 b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
b.小火煮沸溶液1~2 min,赶走溶解在溶液中的CO2气体;
c.在得到的溶液中加入另一半(25mL)NaOH溶液,使其充 分混合反应。
(1)此方案能制得较纯净的Na2CO3,写出c步骤的离子方程式
______________________________________ ________。
此方案第一步的实验装置如右图所示:
(2)加入反应物前,如何检查整个装置的气密性_____________ 。
(3)若用大理石与盐酸制CO2,则装置B中盛放的试剂是_________ _____,作用是___________ _ _______ ________。
(4)在实验室通常制法中,装置A还可作为下列__________(填序号)气体的发生装置。
①CH4 ②H2 ③Cl2 ④CH2=CH2
(5)已知所用NaOH溶液中溶质的质量分数为40%,室温下该溶液密度为1.44 g / mL,假设反应前后溶液的体积不变,不考虑实验误差,计算用此种方法制备所得Na2CO3溶液的物质的量浓度为____________________。
查看答案和解析>>
科目: 来源: 题型:
现有常温下的四份溶液:①0.01 mol/L CH3COOH;②0.01 mol/L HCl;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
A.①中水的电离程度最小,③中水的电离程度最大
B.将②、③混合,若有pH=7,则消耗溶液的体积:②>③
C.将①、④混合,若有c(CH3COO-)>c(H+),则混合液一定呈碱性
D.将四份溶液稀释相同倍数后,溶液的pH:③>④,①>②
查看答案和解析>>
科目: 来源: 题型:
某温度下,在一容积固定的容器中,反应aA(g)+bB(g)![]() hH(g)达到平衡后,
hH(g)达到平衡后,
A、B、H的物质的量分别为amol、bmol和hmol。已知a+b=2h,若保持温度不变,将三者的物质的量增大一倍,则下列判断正确的是
A.平衡不移动 B.混合气体的密度不变
C.B的体积分数减少 D.amol/L<c(A)<2amol/L
查看答案和解析>>
科目: 来源: 题型:
用CH4催化还原NOX可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ?mol-1
下列说法正确的是
A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(1);△H=-Q kJ?mol-1;Q>574
B.等物质的量的甲烷分别参加反应①②,则反应转移的电子数不同
C.若用0.2mol CH4还原足量的NO2至N2,放出的热量为173.4kJ
D.若用标准状况下4.48LCH4还原足量的NO2至N2,整个过程中转移的电子的物质的量为16 mol
查看答案和解析>>
科目: 来源: 题型:
 一定温度下,在密闭容器内进行着某一反应,X气
一定温度下,在密闭容器内进行着某一反应,X气
体(2 mol)、Y气体(10 mol)的物质的量随反应
时间变化的曲线如右图。下列叙述中正确的是
A.反应的化学方程式为5Y![]() X
X
B.t1时,Y的浓度是X浓度的1.5倍
C.t2时,正、逆反应速率相等
D.t3时,逆反应速率大于正反应速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com