
科目: 来源: 题型:
(本题10分)H2O2为绿色氧化剂,为了贮存运输、使用的方便,工业上采用“醇析法”将其转化成固态的过碳酸钠晶体(化学式为2Na2CO3?3 H2O2),该晶体具有Na2CO3和H2O2的双重性质。“醇析法”的生产工艺流程如下:
![]()

(1)写出过氧化氢的电子式 (2分)
(2)写出生成过碳酸钠的化学方程式 (2分)
(3)稳定剂能反应生成难溶物将过碳酸钠粒子包裹住,该反应的化学方程式为: (2分)
(4)加入异丙醇的作用是 (2分)
![]() (5)下列物质不会使过碳酸钙失效的是 (2分)
(5)下列物质不会使过碳酸钙失效的是 (2分)
![]() A.H2S B.醋酸 C.食盐 D.小苏打
A.H2S B.醋酸 C.食盐 D.小苏打
查看答案和解析>>
科目: 来源: 题型:
(本题11分)生产着色铝片的工艺流程如下:
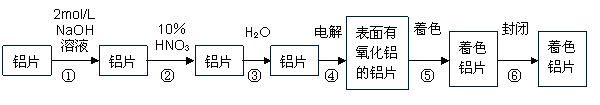
请回答下列问题:
(1)第①步中NaOH溶液的作用是 (1分)
(2)第②步HNO3的作用是对铝片进行抛光,写出其反应的的离子方程式 (2分)
(3)在第④步电解是以铝为阴极,铝片为阳极,在硫酸介质中控制电压电流,使阳极放出O2与Al反应使铝表面形成一层致密的氧化膜。写出有关的电极反应式:
阴极: (2分)阳极: (2分)
(4)氧化膜质量的检验:取出铝片干燥,在氧化膜未经处理的铝片上分别滴一滴氧化膜质量检查液(3gK2CrO4+75mL水+25mL浓盐酸),判断氧化膜质量的依据是 (2分)
![]() A.铝片表面有无光滑 B.比较颜色变化 C.比较质量大小 D.比较反应速率大小
A.铝片表面有无光滑 B.比较颜色变化 C.比较质量大小 D.比较反应速率大小
![]() (5)将已着色的铝干燥后在水蒸气中进行封闭处理约20~30min,封闭的目的是使着色的氧化膜更加致密,有关反应化学方程式是 (2分)
(5)将已着色的铝干燥后在水蒸气中进行封闭处理约20~30min,封闭的目的是使着色的氧化膜更加致密,有关反应化学方程式是 (2分)
查看答案和解析>>
科目: 来源: 题型:
(本题15分)水煤气 (主要成分:CO、H2 ) 是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
![]() C (s) + H2O(g)
C (s) + H2O(g)![]() CO (g) +H2 (g);△H =+131.3kJ•mol-1
CO (g) +H2 (g);△H =+131.3kJ•mol-1
![]() (1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
(1)某温度下,四个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
容器编号 | c(H2O)/mol?L-1 | c(CO)/mol?L-1 | c(H2)/mol?L-1 | V正、V逆比较 |
I | 0.06 | 0.60 | 0.10 | V正=V逆 |
II | 0.06 | 0.50 | 0.40 | ? |
III | 0.12 | 0.40 | 0.80 | V正<V逆 |
IV | 0.12 | 0.30 | ? | V正=V逆 |
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0mol炭和 1.0mo l水蒸气 (H216O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充 a mol 炭,水蒸气的转化率将 (填 “增大”、“减小”、“不变”),再补充 a mol 水蒸气 (H218O), 最终容器中C16O和C18O 的物质的量之比为 。
![]() (3)己知:C (s) +
(3)己知:C (s) + ![]() O2(g)=CO (g);△H = -110.5kJ?mo1-1
O2(g)=CO (g);△H = -110.5kJ?mo1-1
![]() CO(g) +
CO(g) + ![]() O2(g) =CO2 (g);△H =-283.0 kJ?mo1-1
O2(g) =CO2 (g);△H =-283.0 kJ?mo1-1
![]() H2 (g) +
H2 (g) + ![]() O2 (g) =H2O (g);△H = -241.8kJ?mo1-1
O2 (g) =H2O (g);△H = -241.8kJ?mo1-1
![]() 那么,将2.4 g 炭完全转化为水煤气,然后再燃烧,整个过程△H = kJ?mo1-1
那么,将2.4 g 炭完全转化为水煤气,然后再燃烧,整个过程△H = kJ?mo1-1
查看答案和解析>>
科目: 来源: 题型:
(本题12分)印刷电路的废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费。可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。测得某废腐蚀液中含CuCl2 1.5mol/L,含FeCl2 3.0mol/L,含FeCl3 1.0mol/L,含HCl 3.0mol/L。取废腐蚀液200mL按如下流程在实验室进行实验:
![]()

回答下列问题:
(1)上述方法获得的铜粉中含有杂质,除杂所需试剂是
(填化学式)。
(2) 实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物。反应的化学方程式为 。
![]() ⑶ 下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
⑶ 下图是实验室制备Cl2并通入FeCl2溶液中获得FeCl3溶液的部分装置。
![]()


![]()
![]() 从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。
从下图挑选所需的仪器,完成上述装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置不用画),并标明容器中所装试剂。
![]()


![]() ⑷ 实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是: 。
⑷ 实验中,必需控制氯气的速度,使导管口逸出的气泡每秒1~2个,以便被FeCl2溶液完全吸收。控制生成氯气速度的操作是: 。
![]() ⑸ 按上述流程操作,需称取Fe粉的质量应不少于 g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
⑸ 按上述流程操作,需称取Fe粉的质量应不少于 g(精确到0.1g),需通入Cl2的物质的量不少于 mol,加入烧瓶中的KClO3的质量应不少于 g(精确到0.1g)。
查看答案和解析>>
科目: 来源: 题型:
(本题9分)草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol•L1的H2C2O4溶液滴加0.01mol•L1KOH溶液V(mL),回答下列问题。
![]() ①当V<10mL时,反应的离子方程式为 。
①当V<10mL时,反应的离子方程式为 。
![]() ②当V=10mL时,溶液中HC2O4、C2O42、H2C2O4、H+的浓度从大到小的顺序为 。
②当V=10mL时,溶液中HC2O4、C2O42、H2C2O4、H+的浓度从大到小的顺序为 。
![]() ③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42)+c(HC2O4);
③当V=amL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42)+c(HC2O4);
![]() 当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42)+c(HC2O4)+c(H2C2O4);则a b(填“<”,“=”或“>”)。
当V=bmL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42)+c(HC2O4)+c(H2C2O4);则a b(填“<”,“=”或“>”)。
![]() ④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”),原因是 。
④当V=20mL时,再滴入NaOH溶液,则溶液中n(K+) / n(C2O42-)的值将 (填“变大”,“变小”,“不变”),原因是 。
查看答案和解析>>
科目: 来源: 题型:
(本题10分)小明为探究血液中钙离子在血液凝固过程中起重要作用,查资料知道钙离子缺乏则不能凝固,草酸钾溶液能与血液中的钙离子发生反应,形成草酸钙沉淀,起抗凝作用。小明实验后证实该资料的结论是正确的。请根据小明的实验材料和用具,简要写出第二步及以后的实验步骤和实验结果,并回答问题。
(1)实验材料和用具:①家兔 ②生理盐水 ③酒精棉 ④0.1mol/L的草酸钾溶液 ⑤0.1mol/L的氯化钙溶液 ⑥试管 ⑦注射器(针管、针头)。
(2)实验步骤和实验现象
![]() 第一步:在A、B试管中分别加入等量的草酸钾溶液和生理盐水
第一步:在A、B试管中分别加入等量的草酸钾溶液和生理盐水
![]() 第二步: (2分)
第二步: (2分)
![]() 第三步:立即将 (1分)加入到A、B两试管中,可以观察到 (2分)
第三步:立即将 (1分)加入到A、B两试管中,可以观察到 (2分)
![]() 第四步:将 (1分)溶液分别加入到A、B两试管中,可以观察到 (2分)
第四步:将 (1分)溶液分别加入到A、B两试管中,可以观察到 (2分)
(3)设置B管的目的是 (2分)
查看答案和解析>>
科目: 来源: 题型:
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:①元素周期表中,Z与Y相邻,Z与W也相邻;②Y、Z和W三种元素的原子最外层电子数之和为17。下列说法正确的是
![]() A.Y、Z和W三种元素位于同一周期
A.Y、Z和W三种元素位于同一周期
![]() B.Y元素形成的氢化物溶于水呈碱性
B.Y元素形成的氢化物溶于水呈碱性
![]() C.X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1
C.X、Y、Z和W可组成一化合物,其原子个数之比为8:2:4:1
![]() D.Y和W两种元素位于同一主族
D.Y和W两种元素位于同一主族
查看答案和解析>>
科目: 来源: 题型:
漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:5HClO2 = 4 ClO2↑+ H+ +Cl-+2H2O。向NaClO2溶液中滴加H2SO4,开始反应缓慢,随后反应迅速,其原因是
![]() A.在酸性条件下,亚氯酸钠的氧化性增强 B.溶液中的H+起催化作用
A.在酸性条件下,亚氯酸钠的氧化性增强 B.溶液中的H+起催化作用
![]() C.ClO2逸出,使反应的生成物浓度降低 D.溶液中的Cl-起催化作用
C.ClO2逸出,使反应的生成物浓度降低 D.溶液中的Cl-起催化作用
查看答案和解析>>
科目: 来源: 题型:
下列叙述不正确的是
![]() A.常温下,10mL0.02 mol/L HCl溶液与10mL0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
A.常温下,10mL0.02 mol/L HCl溶液与10mL0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12
![]() B.在0.1 mol/LHCOONa溶液中,C(OH-)=C(HCOOH)+C(H+)
B.在0.1 mol/LHCOONa溶液中,C(OH-)=C(HCOOH)+C(H+)
![]() C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.苯酚、淀粉KI、乙酸、氢氧化钾四种溶液可用 FeCl3溶液一次鉴别
查看答案和解析>>
科目: 来源: 题型:
某温度下,将2mo1A和3mo1B充入一密闭容器中,发生反应:aA(g)+B(g)![]() C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化, 则
C(g)+D(g),5min 后达到平衡。已知该温度下其平衡常数K=1 ,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化, 则
![]() A.a=1 B.a =2 C.B的转化率为40 % D.B的转化率为60 %
A.a=1 B.a =2 C.B的转化率为40 % D.B的转化率为60 %
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com