
科目: 来源: 题型:
根据元素周期表和元素周期律分析下面的推断,其中错误的是
A.铍的原子失电子能力比镁弱 B.砹的氢化物不稳定
C.H2Se比H2S稳定 D.NaOH比Mg(OH)2的碱性强
查看答案和解析>>
科目: 来源: 题型:
化学反应的实质是旧键断裂,新键的形成。据此下列变化不属于化学变化的是
![]() A.白磷在260℃时转化为红磷 B.石墨转化为金刚石
A.白磷在260℃时转化为红磷 B.石墨转化为金刚石
![]() C.Na溶于H2O D.NaCl熔化
C.Na溶于H2O D.NaCl熔化
查看答案和解析>>
科目: 来源: 题型:
下列叙述错误的是w.w.w.k.s.5.u.c.o.m
A.随着原子序数增多,碱金属的原子半径逐渐增大
B.卤素单质的熔沸点随着原子序数的增大而降低
C.离子化合物中肯定含离子键
D.原电池的负极发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
(06年江苏卷)(10分)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示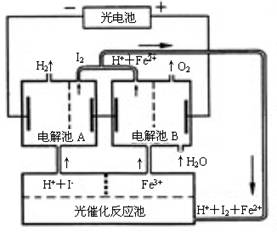 的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
⑴写出电解池A、电解池B和光催化反应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol?L-1和b mol?L-1,光催化反应生成Fe3+的速率为c mol?L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
查看答案和解析>>
科目: 来源: 题型:
用Cu与浓硫酸反应,得到SO2的体积为2.24L(标准状况)。试计算:
(1)被还原的H2SO4的物质的量;
(2)把所得到的CuSO4配制成500mL CuSO4溶液,所得溶液中溶质的物质的量浓度查看答案和解析>>
科目: 来源: 题型:
(7分)在一包固体试样中,可能含有CaCO3 、Na2CO3 、(NH4)2CO3 、Na2SO4、CuSO4,在进行下列实验操作时,发生以下实验现象:
(1)将试样溶解于水时,得到的是无色的溶液;
(2)向溶液中加入BaCl2溶液时,有白色沉淀生成,此沉淀能溶解在稀盐酸中;
(3)溶液的焰色反应为黄色。
根据上述实验事实判断:
在试样中一定存在 ,
一定不存在 ,
可能存在 。
查看答案和解析>>
科目: 来源: 题型:
(7分)A、B、C、D都是短周期元素。A元素的原子核外有两个电子层,最外层已达到饱和。B元素位于A元素的下一周期,最外层的电子数是A元素最外层数的1/2 。C元素的离子带有两个单位正电荷,它的核外电子排布与A元素原子相同。D元素与C元素属同一周期,D元素原子的最外层电子数比A的最外层电子数少1。根据上述事实判断:
A , B , C , D 。
D元素位于 周期 族,
它的最高价氧化物的化学式是: ,最高价氧化物的水化物化学式是 。
查看答案和解析>>
科目: 来源: 题型:
(3分)在周期表中氧化性最强的一族元素是卤素,它们原子最外电子层上的电子数目是 ,该族元素氢化物的通式是 ,最高价氧化物的通式是 ,该族元素氢化物的水溶液显 性(填“酸”或“碱”。下同)。最高氧化物对应水化物显 性。该族元素随核电荷数的递增,原子半径 (填“增大”、“不变”或“减小” )。
查看答案和解析>>
科目: 来源: 题型:
(3分)从核外电子层数和最外层电子数分析核内质子数为11和15的一组原子,它们的 相同, 不相同;核电荷数为7和15的一组原子,它们的 相同, 不相同。原子序数为2的原子,它是 的原子,一般情况下化学性质 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com