
科目: 来源: 题型:
将16mL NO和NH3的混合气体在催化剂作用下,400℃左右发生下列反应:6NO+4NH3![]() 5N2+6H2O,已知反应达平衡后在相同条件下混合气体体积变为17mL。则在原混合气体中,NO和NH3的物质的量之比可能是:
5N2+6H2O,已知反应达平衡后在相同条件下混合气体体积变为17mL。则在原混合气体中,NO和NH3的物质的量之比可能是:
A、3∶5 B、2∶5 C、2∶1 D、3∶1
查看答案和解析>>
科目: 来源: 题型:
向足量H2SO4溶液中加入100mL 0.4 mol?L―1 Ba(OH)2溶液,放出的热量是5.12kJ。如果向足量Ba(OH)2溶液中加入100mL 0.4 mol?L―1 HCl溶液时,放出的热量为2.2kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为:
A.Ba2+(aq)+SO42―(aq)=BaSO4(s) △H=-2.92kJ?mol―1
B.Ba2+(aq)+SO42―(aq)=BaSO4(s) △H=-0.72kJ?mol―1
C.Ba2+(aq)+SO42―(aq)=BaSO4(s) △H=-73kJ?mol―1
D.Ba2+(aq)+SO42―(aq)=BaSO4(s) △H=-18kJ?mol―1
查看答案和解析>>
科目: 来源: 题型:
在一定温度下,反应H2(g)+X2(g)![]() HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于:
HX(g)的平衡常数为10。若将1.0mol的HX(g)通入体积为1.0L的密闭容器中,在该温度时HX(g)的最大分解率接近于:
A.5% B.17% C.25% D.33%
查看答案和解析>>
科目: 来源: 题型:
在浓度为c mol?L-1的AgNO3溶液amL中加入一定量pH=1的盐酸时,恰好使溶液中Ag+完全沉淀,此时得到pH=2的溶液(设反应前后溶液体积变化忽略不计),则c的值是:
A.0.0020 B.0.011 C.0.11 D.0.22
查看答案和解析>>
科目: 来源: 题型:
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
Li+2Li0.35NiO2![]() 2Li0.85NiO2。下列说法不正确的是:
2Li0.85NiO2。下列说法不正确的是:
A.放电时,负极的电极反应式:Li-e-==Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
查看答案和解析>>
科目: 来源: 题型:
碱性锌锰电池工作时的总方程式为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2。关于碱性锌锰电池的说法正确的是:
A.碱性锌锰电池是二次电池
B.正极反应为:2 MnO2+2H2O+2e-=2MnOOH+2OH-
C.连续工作后的碱性锌锰电池中电解液的pH将减小
D.工作中,每转移0.2 mol e-时,负极质量减轻6.5 g
查看答案和解析>>
科目: 来源: 题型:
物质的量浓度均为0.1 mol?L-1的弱酸HX与NaX溶液等体积混合后,有关粒子浓度关系错误的是:
A.c(Na+)+c(H+)=c(X-)+c(OH-)
B.若混合液呈酸性,则c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C.c(HX)+c(X-)=2c(Na+)
D.若混合液呈碱性,则c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
如图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色,则下列说法正确的是: 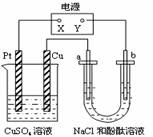
A.x是正极,y是负极,CuSO4溶液的pH逐渐减小
B.x是正极,y是负极,CuSO4溶液的pH保持不变
C.x是负极,y是正极,CuSO4溶液的pH 逐渐减小
D.x是负极,y是正极,CuSO4溶液的pH保持不变
查看答案和解析>>
科目: 来源: 题型:
4.0 mol PCl3和2.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)![]() PCl5(g)达平衡时,PCl5为0.80 mol,如果此时移走2.0 mol PCl3和1. 0 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是:
PCl5(g)达平衡时,PCl5为0.80 mol,如果此时移走2.0 mol PCl3和1. 0 mol Cl2,在相同温度下再达平衡时PCl5的物质的量是:
A.大于0.40 mol,小于0.80 mol B.0.40 mol
C.小于0.40 mol D.0.80 mol
查看答案和解析>>
科目: 来源: 题型:
有如下的可逆反应:X(g)+2Y(g)![]() 2Z(g) 现将X和Y以12的体积比混合在密闭容器中,加压到3×107帕,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是:
2Z(g) 现将X和Y以12的体积比混合在密闭容器中,加压到3×107帕,达到平衡后,已知平衡状态时反应物的总物质的量和生成物的总物质的量相等时,对应图中坐标上的温度是:
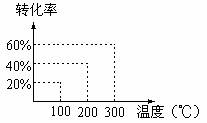
A.100℃ B.200℃ C.300℃ D.不能确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com