
科目: 来源: 题型:
(本题计8分)黄铁矿的主要成分是FeS2,某硫酸厂在进行黄铁矿成分测定时,取0.100 g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.0200 mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00 mL。已知:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。 (1)样品中FeS2的质量分数是(假设杂质不参加反应)_____________________。
(2)若燃烧6 g 纯净的FeS2产生的SO2全部转化为SO3气体时放出9.83 kJ的热量,产生的SO3与水全部化合生成硫酸时放出13.03 kJ的热量。写出接触室中发生反应的热化学方程式______________________________________。
(3)煅烧10 t上述黄铁矿,理论上可制得98%浓硫酸____________________t,SO2全部转化为硫酸时放出的热量是____________________kJ。
查看答案和解析>>
科目: 来源: 题型:
(本题计6分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si―O | Si―Cl | H―H | H―Cl | Si―Si | Si―C |
键能/kJ?mol―1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
(1)比较下列两组物质的熔点高低(填“>”或“<”)
 SiC_________Si;SiCl4_____________________SiO2。
SiC_________Si;SiCl4_____________________SiO2。
(2)右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)=Si(s)+4HCl(g),该反应的反应热ΔH=___________________kJ?mol―1。
查看答案和解析>>
科目: 来源: 题型:
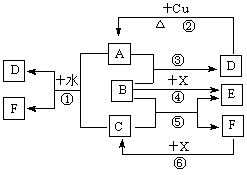 (本题计7分)已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,实验室由B制E、由F的浓溶液加热制C时都用到黑色粉末X,B分子中有18个电子。反应中部分生成物已略去。试回答下列问题:
(本题计7分)已知A-F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,实验室由B制E、由F的浓溶液加热制C时都用到黑色粉末X,B分子中有18个电子。反应中部分生成物已略去。试回答下列问题:
(1)B的结构式为________________________________。
(2)写出化学方程式:②_____________________________________________;⑤____________________________________________________
(3)写出离子方程式:①_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
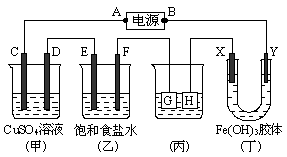 (本题计8分)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(本题计8分)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A极的名称是____________。
(2)装置甲中C电极的电极反应式为_______________________。
(3)装置乙中电解反应的总方程式是___________________________________________。
(4)欲用丙装置给铜镀银,G应该是_______________(填“铜”或“银”)电极,电镀液的主要成分是__________________(填化学式)。若外电路中通过0.1 mol电子时,H电极的质量改变是____________________g。
(5)装置丁中的现象是______________________,说明___________________________________。
查看答案和解析>>
科目: 来源: 题型:
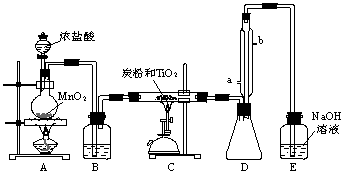 (本题计9分)四氯化钛是无色液体,沸点为136℃,它极易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。TiCl4可由TiO2与Cl2反应制得(TiO2不与HCl反应)。此反应在1000℃高温下进行的很慢,但如果有炭粉存在时650℃~850℃反应便可顺利进行。右图是某同学设计的实验室制备TiCl4的装置。请回答:
(本题计9分)四氯化钛是无色液体,沸点为136℃,它极易水解,遇空气中的水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。TiCl4可由TiO2与Cl2反应制得(TiO2不与HCl反应)。此反应在1000℃高温下进行的很慢,但如果有炭粉存在时650℃~850℃反应便可顺利进行。右图是某同学设计的实验室制备TiCl4的装置。请回答:
(1)A装置中反应的化学方程式为___________________________________________。
(2)B装置中的试剂为________________,作用是______________________________。
(3)实验中炭粉的作用为_______________________。
(4)D装置中冷凝水的水流方向为____________进____________出,该装置的作用是_________________。
(5)E装置中NaOH溶液的作用是_______________________________________。
(6)该设计方案中除分液漏斗中的浓盐酸不能顺利滴下、E不能封口和可能倒吸外,还有一处明显的不足是_______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(本题计6分)老师在足量的稀FeBr2溶液中,加入1~2滴溴水,振荡,溶液变为浅黄色。
(1)甲同学认为这不是发生化学反应所致,他认为使溶液变黄的物质是(填写相关微粒的化学式)______________;乙同学认为这是化学反应所致,他认为使溶液变黄的是(填写相关微粒的化学式)__________________。
(2)老师提供以下试剂:A―酸性KMnO4溶液、B―CCl4、C―KI溶液、D―KSCN溶液。请你验证乙同学的推断是正确的,你选择的试剂是(填编号)___________,实验中观察到的现象是:______________________________________。
(3)根据上述实验的事实推测,若在FeBr2溶液中通入Cl2,先后发生的反应分别是(用离子方程式表示):______________________________、___________________________。
查看答案和解析>>
科目: 来源: 题型:
(Ⅰ)“化学――人类进步的关键”。日常生活、社会生产中的许多问题都涉及到化学知识。下列有关说法中正确的是(填序号,多选倒扣分)___________________________________________。
A、冰的密度小于液态水,氨易液化,均与氢键有关
B、明矾净水,血液透析,均与胶体知识有关
C、从经济效益等方面综合考虑,硫酸厂在常压和合适温度下催化氧化SO2,且应在距离原料产地近的地方建厂
D、我国生产硫酸的主要原料是黄铁矿、水、空气
E、生产水泥、玻璃的共同原料是石灰石
F、用除去油污的废铁屑与过量的稀硫酸制备绿矾(FeSO4?7H2O)
G、晶体硅常用作光导纤维材料
H、氯碱工业中用阳离子交换膜将电解槽分为阳极室和阴极室,精制饱和食盐水送入阴极室
I、干冰、溴化银常用于人工降雨
J、硫酸铜晶体中结晶水含量测定实验中至少加热2次,称量4次
(Ⅱ)、某无色混合气体可能含有CO2、CO、H2O(气)、H2中的一种或几种,依次进行如下处理(假定每步处理均反应完全)。(1)通过碱石灰时,气体体积变小;(2)通过赤热的CuO时,固体变为红色;(3)通过白色CuSO4粉末时,粉末变为蓝色;(4)通过澄清的石灰水时,溶液变浑浊。由此可以确定原混合气体的成分可能是(已给出一种可能,还有几种可能就填几种,可不填满)。CO、H2、CO2、、______________、_______________、_______________、_____________、_____________。
查看答案和解析>>
科目: 来源: 题型:
下列离子方程式书写正确的是
A、氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B、实验室制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
C、大理石与盐酸反应:CO32-+2H+=CO2↑+H2O
D、硫酸厂用稍过量的氨水吸收SO2:NH3?H2O+SO2=NH4++HSO3-
查看答案和解析>>
科目: 来源: 题型:
镍-镉可充电电池,电极材料是Cd和NiO(OH),电解质是氢氧化钾,放电时的电极反应是: Cd+2OH--2e-=Cd(OH)2,2NiO(OH)+2H2O+2e-=2Ni(OH)2+2OH-,下列说法不正确的是
A、电池放电时,电池负极周围溶液的pH不断增大
B、电池的总反应是Cd+2NiO(OH)+2H2O=Cd(OH)2+2Ni(OH)2
C、电池充电时,镉(Cd)元素被还原
D、电池充电时,电池的正极和充电电源的正极连接
查看答案和解析>>
科目: 来源: 题型:
已知:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol。在一密闭容器中充入2 mol N2、6 mol H2一定条件下充分反应,对反应放出的热量的说法一定正确的是
2NH3(g);ΔH=-92.4 kJ/mol。在一密闭容器中充入2 mol N2、6 mol H2一定条件下充分反应,对反应放出的热量的说法一定正确的是
A、184.8 kJ B、92.4 kJ C、<184.8 kJ D、<92.4 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com