
科目: 来源: 题型:
在乙烯分子中有5个σ键、一个π键,它们分别是
A.sp2杂化轨道形成σ键、未杂化的2p轨道形成π键
B.sp2杂化轨道形成π键、未杂化的2p轨道形成σ键
C.C-H之间是sp2形成的σ键,C-C之间是未参加杂化的2p轨道形成的π键
D.C-C之间是sp2形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键
查看答案和解析>>
科目: 来源: 题型:
下列关于晶体的说法正确的组合是
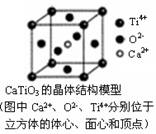 ①分子晶体中都存在共价键
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如图所示)每个Ti4+和12个O2-相紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目: 来源: 题型:
第3周期元素的原子,其最外层p能级上仅有一个未成对电子,其余均成对,它最高价氧化物对应的水化物的酸根离子是
A.RO3― B.RO5― C.RO42― D.RO4―
查看答案和解析>>
科目: 来源: 题型:
下列关于元素第一电离能的说法不正确的是
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能必依次增大
C.最外层电子排布为ns2np6(若只有K层时为1s2)的原子,第一电离能较大
D.对于同一元素而言,原子的逐级电离能越来越大
查看答案和解析>>
科目: 来源: 题型:
英国研究人员 2007 年 8 月 30 日发表报告认为,全球将有 1.4 亿人因为用水而受到砷中毒之害、导致更多的人患癌症。海带含砷超标,经水浸泡 24 小时后,其含砷量才能达到食用安全标准。下列对砷 ( As )的有关判断正确的是
A.砷原子序数为 33 ,它与铝为同主族
B.砷的原子半径小于磷的原子半径
C.砷化氢的稳定性比溴化氢的强
D.砷酸的酸性比硫酸的弱
查看答案和解析>>
科目: 来源: 题型:
“神舟六号”所用动力燃料之一为氢化锂三兄弟――LiH、LiD、LiT。其中Li的质量数为7,有关下列叙述中正确的是
A. 三种物质质子数之比为1:2:3
B.三种物质中子数之比为1:1:1
C.三种物质的摩尔质量之比为8:9:10
D.三种物质的化学性质不相同
查看答案和解析>>
科目: 来源: 题型:
(10分)右图是用铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。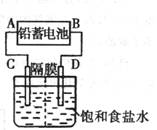
已知:铅蓄电池在放电时发生下列电极反应
负极:![]()
正极:![]()
(1)请写出电解饱和食盐水的化学方程式 ;
(2)若在电解池中C极一侧滴2滴酚酞试液、电解一段时间后,未呈红色,说明蓄电池的A极为 极
(3)用铅蓄电池电解1 L饱和食盐水(食盐水足量、密度为1.15 g/cm3)时:
①若收集到11.2 L(标准状况下)氯气,则至少转移电子 mol。
②若蓄电池消耗H2SO4 2 mol,则可收集到H2的体积(标准状况下)为 L。
③若消耗硫酸![]() mol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出) (用含
mol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出) (用含![]() 的代数式表达)。
的代数式表达)。
查看答案和解析>>
科目: 来源: 题型:
(6分)磷在空气中充分燃烧,生成X的分子结构如右图所示.图中实线表示化学键,圆圈表示原子(不考虑原子体积大小)
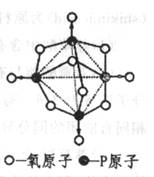
(1)由右图可知,X的分子式为 。
(2)X分子内的磷原子所形成的空间几何形状是
。
(3)X分子中共含有P―O―P键 个。
(4)磷在氧气中燃烧,可能生成两种固态氧化物。31 g的单质磷(P)在32 g氧气中燃烧,至反应物耗尽,放出![]() kJ热量。已知单质磷(P)的燃烧热为6 kJ/mol,则:1 mol P与O2反应生成固态P2O3放出 kJ热量。写出1 mol P与O2反应生成固态P2O3的热化学方程式: 。
kJ热量。已知单质磷(P)的燃烧热为6 kJ/mol,则:1 mol P与O2反应生成固态P2O3放出 kJ热量。写出1 mol P与O2反应生成固态P2O3的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com