
科目: 来源: 题型:
某无色溶液中可能含有①Na+、②Ba2+、③Cl-、④Br-、⑤SO32-、⑥SO42-离子中的若干种,依顺序进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤 | 操作 | 现象 |
1 | 用pH试纸检验 | 溶液的pH大于7 |
2 | 向溶液中滴加氯水,再加入CCl4振荡,静置 | CCl4层呈橙色 |
3 | 向所得水溶液中加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀产生 |
4 | 过滤,向滤液中加入AgNO3溶液 | 有白色沉淀产生 |
下列结论正确的是
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑥
C.不能确定的离子是① D.不能确定的离子是③⑤
查看答案和解析>>
科目: 来源: 题型:
在20L恒容的密闭容器中,加入3mo1SO3(g)和lmo1氧气,在一定温度下使其反应,反应至4min时,氧气的浓度为0.09 mol?L-1,当反应到8min时,反应到达平衡,此时三氧化硫浓度c(SO3)= a mol?L-1。
(1) 0min~4min内生成O2平均速率v(O2)= mol?L-1?min-1
(2) 达到平衡时c(O2)=c(SO2),则a= mol?L-1。
(3) 在下列坐标系中作出0min~8min及之后SO2、O2、SO3浓度随时间变化曲线. ![]()
![]()
![]()
![]()
![]()
![]()
![]()
查看答案和解析>>
科目: 来源: 题型:
(8分)某有机物A在氧气中燃烧时,只生成CO2和水蒸气,经测定A中碳的质量分数为40,氢的质量分数为6.67。A的蒸气密度是相同状况下乙烷气体密度的3倍,试回答下列问题:
(1)A的分子式为 。
(2)若9.0g与足量钠反应可产生2.24L标准状况下的氢气,每9.0gA与乙醇恰好完全反应可生成0.1mol酯和1.8g水,则A中所含的官能团名称为 。
(3)经红外光谱测定A在催化剂存在时可被氧气氧化成一种二元酸,则A的结构简式为 。
(4)A与浓硫酸共热时可生成酯,其分子式为C6H8O4的结构简式为 。
查看答案和解析>>
科目: 来源: 题型:
(8分)一种新燃料电池,一极通入空气(设空气中氮气体积为4/5),另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,在熔融状态下能传导O2-,试回答下列问题:
(1)在熔融电解质中,O2-移向 极(填“正”或“负”)
(2)空气通入的一极是此燃料电池的 极(填“正”或“负”),
![]() 通入丁烷的电极上发生的电极反应式是
通入丁烷的电极上发生的电极反应式是
(3)用此燃料电池来电解CuCl2溶液,当阳极产生0.5摩尔气体,则电池的一极通入空气在标况下的体积至少为__________L.
查看答案和解析>>
科目: 来源: 题型:
(14分) A、B、C、X均为常见的纯净物,它们之间有如下转化关系(副产品已略去)。
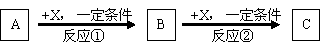
试回答:
(1)若X是强氧化性单质,则A不可能是 。
a. S b. N2 c. Na d. C2H5OH e. Al
(2)若X是金属单质,向C的水溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则B的化学式为 ;C溶液在贮存时应加入少量X,理由是(用必要的离子方程式和文字说明):_____________________________。检验此C溶液中金属元素价态的操作方法是:____________________________________。
(3)若A、B、C为含某金属元素的无机化合物,X为强电解质,则B的化学式为 ,X的化学式可能为(写出一种物质)__________________,反应①的离子方程式为 _____________________________。
查看答案和解析>>
科目: 来源: 题型:
下列实验方法合理的是
A、加新制的Cu(OH)2并加热,确定尿液中混有葡萄糖
B、油脂皂化后可用渗析的方法使高级脂肪酸钠和甘油充分分离
C、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液
D、用分液漏斗将甘油和水的混合液体分离
查看答案和解析>>
科目: 来源: 题型:
利用合成气(H2+CO)生产汽油、甲醇等已经实现了工业化,合成气也可合成醛、羧酸、酯等多种产物,下列叙述正确的是
①以合成气为原料的反应都是化合反应
②改变合成气中CO与H2的体积比,可得到不同的产物
③合成气的转化反应通常需在适当的温度和压强下通过催化完成
④从合成气出发生成液态烃或醇类有机物是实现“煤变油”的有效途径
⑤以合成气为原料的反应产物中不可能有烯烃或水
A、①②④ B、②③④ C、②④⑤ D、③④⑤
查看答案和解析>>
科目: 来源: 题型:
双氧水(H2O2)常温下是一种液体,难电离,易分解。工业上常用的绿色氧化剂。为贮存和运输的方便,工业上将其转化成固态的过碳酸钠晶体(2Na2CO3?3H2O2),该晶体具有Na2CO3和H2O2的双重性质。由上述材料,下列说法错误的是
A、H2O2的结构式为H-O-O-H B、H2O2的氧化产物为H2O,不产生污染物
C、醋酸会使过碳酸钠失效 D、向H2O2溶液中加入少量的FeCl3,会加快其分解
查看答案和解析>>
科目: 来源: 题型:
下列叙述正确的是
A、医疗上常用无水乙醇消毒
B、硫酸铵和硫酸铜均能使鸡蛋白溶液发生盐析
C、C(石墨,s)====C(金刚石,s) △H>0,所以金刚石比石墨稳定
D、明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理不同
查看答案和解析>>
科目: 来源: 题型:阅读理解
(16分)用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3。10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g。常温下,从溶液中析出的晶体是Na2S2O3?5H2O。Na2S2O3在酸性溶液中立即完全分解:
Na2S2O3+2HCl=S↓+SO2↑+H2O+2NaCl
现取15.1gNa2SO3,溶于80.0mL水。另取5.00g硫粉,用少许乙醇润湿后(以便硫能被水浸润),加到上述溶液中。用小火加热至微沸,反应约1h后过滤。滤液在100℃经蒸发、浓缩、冷却至10℃后析出Na2S2O3?5H2O晶体。
⑴若加入的硫粉不用乙醇润湿,对反应的影响是 。(填写选项的字母,可以多选,但选错要倒扣。)
A.会降低反应速率 B.需要提高反应温度
C.将增大反应体系的pH值 D.会减少产量
⑵反应1h后过滤,其目的是 。
⑶滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是 。它是由 而产生的。如果滤液中该杂质的含量不很低,其检测的方法是: 。
⑷设Na2SO3跟硫粉完全反应,当将滤液蒸发浓缩后,冷却至70℃,溶液的体积约30mL,该溶液是否达到饱和?试通过计算说明。(70℃时,Na2S2O3饱和溶液的密度为1.17g/cm3)
⑸若要计算在100℃下将溶液蒸发至体积为30.0mL,再冷却至10℃时所能得到的Na2SO3?5H2O的质量,你认为 。(填写一个选项的字母)
A.前面提供的数据已经足够。
B.还需要提供100℃时溶液的密度(1.14g/cm3)。
C.还需要提供结晶后剩余溶液的体积(10.0mL)。
⑹根据第(5)小题你的选择(如选A则直接计算,如选B或C则可选用其数据),计算从10℃、30.0mL溶液中结晶而出的Na2S2O3?5H2O的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com