
科目: 来源: 题型:
(11分)以Ba(OH)2?8H2O 和无水TiO2粉体为反应物,在300℃时连续反应8h得到BaTiO3晶体。该晶体具有显著的压电性能,用于超声波发生装置中。该晶体中每个Ba2+离子被12个O2-离子包围形成立方八面体;BaO12十二面体在晶体中的趋向相同,根据配位多面体生长习性法则的特例,晶体的理论习性与BaO12多面体的形状相同。由于BaO12多面体的形状为立方八面体,因此该晶体的生长习性为立方八面体。
和无水TiO2粉体为反应物,在300℃时连续反应8h得到BaTiO3晶体。该晶体具有显著的压电性能,用于超声波发生装置中。该晶体中每个Ba2+离子被12个O2-离子包围形成立方八面体;BaO12十二面体在晶体中的趋向相同,根据配位多面体生长习性法则的特例,晶体的理论习性与BaO12多面体的形状相同。由于BaO12多面体的形状为立方八面体,因此该晶体的生长习性为立方八面体。
1.BaTiO3晶体的晶胞如右图所示。该晶体中Ba、O联合组成哪种类型的堆积形式;Ti的O配位数和O的Ba配位数分别是多少?
2.我们在研究该晶体时,溶液中存在的生长基元为2种阴离子,其O配位数与晶体中相同。请写出这2种生长基元和形成生长基元的反应方程式。
3.右图所示CeO2结构,O2-离子位于各小立方体的角顶,而Ce4+离子位于小立方体的中心。判断CeO2晶体的生长习性为什么,说明判断理由。
4.判断NaCl晶体的生长习性,画出NaCl晶胞中体现其 生长习性的单元。
生长习性的单元。
查看答案和解析>>
科目: 来源: 题型:
(6分)吡啶-2-甲酸,是重要的有机合成中间体。电化学直接氧化2-甲基吡啶法是一条对环境友好的绿色合成路线。下表是某研究者通过实验获得的最佳合成条件。
| 2-甲基吡啶 | H2SO4 | 阳极电位 | 反应温度 | 选择性 | 电流效率 |
一 | 0.5mol/L | 1.5mol/L | 1.95V | 40℃ | 95.3% | 45.3% |
二 | 0.6mol/L | 1.5mol/L | 1.85V | 30℃ | 84.1% | 52.5% |
1.写出制备吡啶-2-甲酸的电极反应方程式;
2.比较途径一、二,引起选择性、电流效率不同的原因是什么?请用电极反应表示。
查看答案和解析>>
科目: 来源: 题型:
(7分)乙烯的制备可以用卤代烷脱卤化氢和乙醇脱水的方法制取。实验室制取乙烯通常采用95%的乙醇和浓硫酸(体积比为1∶3),混合后在碎瓷片的存在下迅速加热到160~180℃制得。
1.实验室为什么不采用氯乙烷脱氯化氢进行制备;
2.实验室用乙醇浓硫酸法制取乙烯中浓硫酸的作用是什么?
3.列举实验室用乙醇浓硫酸法制取乙烯的不足之处;
4.有人建议用浓磷酸代替浓硫酸与乙醇反应,结果发现按醇酸体积比为(1∶3)进行反应时,反应混合物在110℃已经沸腾,温度升到250℃以上仍没有乙烯产生。
(1)解释实验现象;
(2)请提出进一步改进实验的方案。
查看答案和解析>>
科目: 来源: 题型:
(7分)有人建议根据“最高价阳离子”电子排布的相似性和差异性来分主副族。例如:S、Cr规定为ⅥA族;Se规定为ⅥB族。
1.写出S、Cr、Se最高价阳离子的电子构型;
2.周期数和每周期元素个数是否发生变化;
3.新旧周期表中哪些族的元素是统一的(即完全相同)
4.不同的新的主、副族元素在原周期表的基础上做怎样的变动?
查看答案和解析>>
科目: 来源: 题型:
(8分)
1.将尿素与钠分散液在60~110℃发生反应,然后加热(140~200℃)可制备NaCNO。该方法同氧化法相比,能够制备较纯净的氰酸盐。写出反应方程式。
2.含某化合物的较浓的溶液中加入少量的AgNO3溶液出现白色沉淀,然后滴加几滴浓NaOH溶液,振荡后沉淀立即溶解。写出反应方程式。
3.用Mn2O3/H2SO4直接氧化法将对溴甲苯氧化对溴苯甲醛是一条绿色工艺流程,写出反应方程式。
查看答案和解析>>
科目: 来源: 题型:
(6分)交警为确定驾驶员是否酒醉后驾车,常采用呼吸测醉分析法。在310K时取50.0cm3被检测人的呼吸样品鼓泡通过酸性重铬酸盐溶液。由于乙醇的还原作用产生了3.30×10-5mol Cr(Ⅲ),重铬酸盐的消耗可用分光光度法测定。法律上规定血液中的乙醇含量超过0.05%(质量百分数)便算酒醉。请回答以下问题:
(1) 写出以上检测反应的离子方程式:
(2) 请通过计算确定此人是否为法定的酒醉。计算中假定:310K时,含有0.45%乙醇的血液上面乙醇的分压为1.00×104Pa。
查看答案和解析>>
科目: 来源: 题型:
(4分)NiO晶体为NaCl型结构,将它在氧气中加热,部分Ni2+被氧化为Ni3+,晶体结构产生镍离子缺位的缺陷,其组成成为NixO(x<1),但晶体仍保持电中性。经测定NixO的立方晶胞参数a=4.157Å,密度为6.47g?cm-3。
(1) x的值(精确到两位有效数字)为 ;写出标明Ni的价态的NixO晶体的化学式 。
(2) 在NixO晶体中Ni占据 空隙,占有率是 。
查看答案和解析>>
科目: 来源: 题型:
(9分)在合成某些铬的配合物时进行以下反应:
(a) 新制备的CrBr2+溶于稀HCl溶液中的2,2-联吡啶(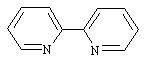 ,相对分子质量:156.18,可简写为“dipy”)→黑色结晶沉淀A。
,相对分子质量:156.18,可简写为“dipy”)→黑色结晶沉淀A。
(b) A+5%HClO4![]() ,黄色晶状沉淀B。
,黄色晶状沉淀B。
(c) A溶解在无空气的并含有过量NH4ClO4的蒸馏水中+Mg![]() 深蓝色化合物C。
深蓝色化合物C。
化学分析和磁性测量结果如下:
化合物 | 重量% |
μ(B.M.) | ||||
N | Br | Cl | Cr | ClO4 | ||
A | 11.17 | 21.24 |
| 6.91 |
| 3.27 |
B | 10.27 |
| 12.99 | 6.35 |
| 3.76 |
C | 13.56 |
|
| 8.39 | 16.04 | 2.05 |
问:(1) 根据上述数据推出化合物A、B和C的结构式:
A B C
由磁性数据可推测C中未成对电子数目是 个。
(2) (a)中为什么要用新制备的CrBr2?
。
查看答案和解析>>
科目: 来源: 题型:
(7分)实验发现,298K时,在FeCl3的酸性溶液中通入氢气,Fe3+被还原成Fe2+离子的反应并不能发生,但在FeCl3酸性溶液中加少量锌粒后反应该立即进行。有人用“新生态”概念解释此实验现象,认为锌与酸作用时产生的“新生态”氢原子H*来不及结合成H2即与FeCl3作用,反应式为:Zn+2H+![]() 2H*+Zn2+,H*+FeCl3
2H*+Zn2+,H*+FeCl3![]() FeCl2+HCl。但这种解释争议颇多。有化学工作者指出,根据298K时两电对的标准电极电势E$(Zn2+/Zn)=-0.763V,
FeCl2+HCl。但这种解释争议颇多。有化学工作者指出,根据298K时两电对的标准电极电势E$(Zn2+/Zn)=-0.763V,
E$ (Fe3+/Fe2+)=0.771V和设计下述原电池实验即可判断上述解释正确与否:
在两只烧杯中分别装入ZnSO4和FeCl3溶液,再在ZnSO4中插入锌片,在FeCl3中插入铂片,并加数滴KSCN使溶液呈红色,将两极用盐桥连接后,装有FeCl3溶液的烧杯中的红色逐渐褪去。如果在FeCl3溶液内加少量酸,褪色更快。请回答下列问题:
(1) 所设计的原电池符号是 ;
(2) 该原电池的正极反应是 ;
负极反应是 ;
原电池的总反应是 。
(3) 上述关于“新生态”H*的解释是否正确 (填“是”或“否”),理由是:
。
(4) 说明加酸后褪色更快的原因: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com