
科目: 来源: 题型:
(11分)碳酸钙是自然界中分布最广的一种碳酸盐,碳酸钙难溶于水,但能溶于CO2的水溶液中。碳酸钙矿床的地下水流出地面后,由于压强减小而放出CO2,年深日久可形成石笋或钟乳石。25℃时,大气中的CO2分压约为pCO2=3×10-4≈10-3.54 atm。已知:
CO2(g)+H2O=H2CO3 K0=[H2CO3]/pCO2=10-1.47
H2CO3![]() H++HCO3- K1=10-6.4 pK2=10.3
H++HCO3- K1=10-6.4 pK2=10.3
CaCO3(s)![]() Ca2++CO32- Ksp=10-8.3
Ca2++CO32- Ksp=10-8.3
1.写出石灰岩地区形成钟乳石的化学方程式。
2.试计算雨水的pH及CO32-浓度。若测得某时某地雨水的pH为5.4,试分析产生此结果的可能的原因。
3.石灰岩地区的地下水流入河水,设河水pH=7,在25℃、pCO2=10-3.54 atm下,当达到平衡时,Ca2+浓度是多少?
4.试述NaHCO3比Na2CO3溶解度小的原因。
查看答案和解析>>
科目: 来源: 题型:
(13分)Parecoxib为第二代环氧合酶―2(COX一2),由美国Phamarcia公司专为治疗与外科手术或外伤有关的剧烈疼痛而开发,其合成路线如下:
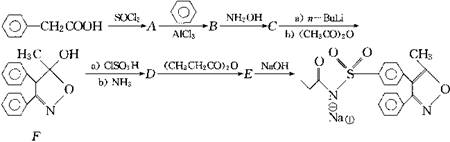
1.写出A~E的结构简式。
2.命名A和B。
4.为什么E可与NaOH反应?
4.用标出化合物F中所有的手性碳,F的光学异构体数目为 。
查看答案和解析>>
科目: 来源: 题型:
(5分)称取含CaCO3 60%的试样0.25g,用酸溶解后加入过量(NH4)2C2O4,使Ca2+沉淀为CaC2O4。在过滤、洗涤沉淀时,为了使沉淀溶解损失造成的误差不大于万分之一,应该用100mL质量百分比浓度至少为多少的(NH4)2C2O4作洗涤液?已知溶液中当Ca2+和C2O42―离子物质的量浓度的乘积等于或大于2.3×10-9时会析出CaC2O4沉淀。
查看答案和解析>>
科目: 来源: 题型:
(11分)某元素A能直接与ⅦA族某一元素B反应生成A的最高价化合物C,C为一无色而有刺鼻臭味的气体,对空气相对密度约为3.61倍,在C中B的含量占73.00%,在A的最高价氧化物D中,氧的质量占53.24%。
1.列出算式,写出字母A、B、C、D所代表的元素符号或分子式。
2.C为某工厂排放的废气,污染环境,提出一种最有效的清除C的化学方法,写出其化学方程式。
3.A的最简单氢化物可与AgNO3反应,析出银,写出化学方程式。
查看答案和解析>>
科目: 来源: 题型:
(8分)草酸铂亦称奥沙利铂,是继顺铂之后的第三代铂类抗肿瘤临床药物,它由K2PtCl4与1,2-二胺基环己烷(A)经下列反应而得(D)。
K2PtCl4+A![]() B
B![]() C
C![]() D
D
1.画出A、B、C、D的化学结构式
2.写出B→C、C→D和D热分解的反应方程式。
查看答案和解析>>
科目: 来源: 题型:
(12分) “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如氧化亚铁硫杆菌在溶液中能将黄铁矿氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如氧化亚铁硫杆菌在溶液中能将黄铁矿氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如下:
1.(1)从生物代谢看,(b)过程属 作用;
(2)氧化亚铁硫杆菌的代谢类型应是 。
2.写出(a)过程的化学反应方程式。
3.人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,请你写出其离子反应方程式。
4.工业上可利用粗铜(含Zn、Ag、Au等)经电解制得精铜(电解铜)。写出电解过程中的电极材料和电极反应。某工厂按此原理,平均每秒生产A mol精铜,求电解机槽中平均电流强度。(设阿伏加德罗常数为 N,每个电子带电量为e C)
5.请评价细菌冶金的优点。
查看答案和解析>>
科目: 来源: 题型:
(8分)SO3和O3的混合气体经光解作用可产生两种气体A和B。其摩尔质量之比约是13。经振动光谱测试:气体B具有两种不同的氧原子。
1.确定A和B物质,并画出B分子的结构。
2.上述反应可看作光化学反应。请写出上述两步反应的反应机理。
3.请根据B的物质结构预测其稳定性和化学性质。
查看答案和解析>>
科目: 来源: 题型:
(8分)红磷是暗红色粉末,需密封保存,若保存不当易变质,呈粘稠状。变质后的物质用水洗涤、过滤,将固体物干燥,得到纯净的红磷。向洗涤液中滴入硝酸银溶液,得到黑色固体和无色气体,该气体在空气中变成棕色气体。
1.用化学方程式表示红磷保存不当变质的原因,及洗涤液和AgNO3所发生的反应。
2.洗涤液中所溶物质为A,A是P通过五个共价键和其他原子结合的产物,其中含有2个-OH,请写出该物质的结构式。
3.写出A物质和过量NaOH溶液反应的离子方程式。
查看答案和解析>>
科目: 来源: 题型:
(8分)不同温度下CuSO4?5H2O脱水的平衡压力为:
化 学 反 应 | p(H2O)/kPa | |
298K | 323K | |
(1)CuSO4?5H2O(s) | 1.04 | 6.05 |
(2)CuSO4?3H2O(s) | 0.75 | 4.12 |
(3)CuSO4?H2O(s) | 0.11 | 0.60 |
平衡关系表明:298K时,若p(H2O)>1.04kPa,CuSO4?5H2O不分解;p(H2O)=1.04kPa表明CuSO4?5H2O和CuSO4?3H2O处于平衡;1.04kPa>p(H2O)>0.75kPa,是CuSO4?3H2O稳定区,而没有CuSO4?5H2O、CuSO4?H2O和CuSO4;p(H2O)=0.75 kPa是CuSO4?3H2O和CuSO4?H2O处于平衡……
1.请把以上结果按下列要求作图

2.若CuSO4?5H2O(固)处于水的饱和蒸气压,如3.13kPa(298K)、12.3kPa(323K)下,可能会发生什么作用?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com