
科目: 来源: 题型:
按下列实验方法能够达到要求的是
A.用10mL量筒量取7.50mL稀盐酸
B.用托盘天平称量25.20g NaCl晶体
C.用PH试纸测得某碱溶液的PH=12.7
D.用25mL碱式滴定管量出14.80mL NaOH溶液
查看答案和解析>>
科目: 来源: 题型:
美国等国家发射的航天器将我国研制的磁谱仪带入太空,其目的是探索反物质。反物质的主要特征是电子带正电荷,质子带负电荷。以下表示反物质酸碱中和反应的通式是
A.H-+OH+=H2O B. H++OH+=H2O
C. H-+OH-=H2O D. H++OH-=H2O
查看答案和解析>>
科目: 来源: 题型:
4月15日晚,重庆某工厂不慎将大量氯气泄漏到周围空间,此时可用浸有一定浓度某物质水溶液的毛巾捂住鼻子。下列最适宜采用的物质是
A.NaOH B.NaCl C.Na2CO3 D.KBr
查看答案和解析>>
科目: 来源: 题型:
接触法制硫酸排放的尾气中,含有少量的二氧化硫,为防止污染环境,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的1×104米3尾气中二氧化硫的含量为0.2%(体积)。问用NaOH溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少kg石膏(CaSO4?2H2O)。
(2)工厂在尾气处理石膏的过程中,中间产物是亚硫酸氢钠,调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量最佳比例,从而提高亚硫酸氢钠的产量。现设n(SO2)、n(NaOH)、n(NaHSO3)分别表示相应物质的量,且![]() ,试写出X在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
,试写出X在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
| n(NaHSO3) |
|
|
|
|
|
|
查看答案和解析>>
科目: 来源: 题型:
(12分)氢是最小的原子,但是它对于世界上物质结构和种类的丰富性却起着举足轻重的作用。氢与许多元素都能形成简单的无机小分子,其分子结构往往与中心原子的性质有关。
⑴ NH3、PH3、AsH3、SbH3分子的键角分别为107.3、93.3、91.8、91.3度,试解释其键角逐渐减小的原因 。
⑵ 试预测CH4、NH3、H2O分子的键角大小顺序 。
⑶ 最新研究发现,水能凝结成13种类型的结晶体,除普通冰以外其余各自的冰都有自己奇特的性质:有在-30℃才凝固的超低温冰,它的坚硬程度可和钢相媲美,能抵挡炮弹轰击;有在180℃高温下依然不变的热冰;还有的冰密度比水大,号称重冰。
① 重冰属于立方晶系,结构如左下图,晶胞参数a=0.333.7pm(即图中立方体的边长,1pm=10-12m),计算其密度为 。其中氧原子的杂化方式为 。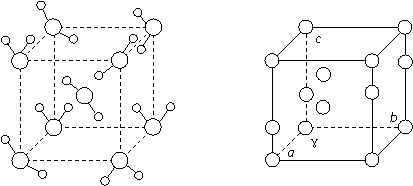
② 普通冰属于六方晶系,晶胞参数为a=452pm,c=737pm,γ=120°,如右上图,白球表示氧原子,一个晶胞中有4个水分子,计算其密度为 。并与重冰比较,可能的原因为 。
查看答案和解析>>
科目: 来源: 题型:
(10分)二氧化硫和氮的氧化物是大气的主要污染物,防止和治理环境污染是当前环保工作的重要研究内容之一。
⑴ 一定条件下,2SO2(g)+O2(g)![]() 2SO3(g),向2L密闭容器中通人2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率 50%(选填“>”、“<”或“=”)。
2SO3(g),向2L密闭容器中通人2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的转化率为50%,则该可逆反应的平衡常数K= ;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率 50%(选填“>”、“<”或“=”)。
![]() ⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。试写出总反应方程式: ,现有1L NO2、NO混合气体NOx将其还原成N2,需同温同压下CH4的体积0.
⑵ 用CH4催化还原NOx为N2可以消除氮氧化物的污染。试写出总反应方程式: ,现有1L NO2、NO混合气体NOx将其还原成N2,需同温同压下CH4的体积0.
![]() ⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
⑶ 新型纳米材料氧缺位铁酸盐(ZnFe2Ox),由铁酸盐(ZnFe2O4)经高温还原制得,常温下,它能使工业废气中的酸性氧化物分解除去,转化流程如图所示:
![]()

![]() 若2mol ZnFe2Ox与SO2可生成0.75mol S,x= 。则可分解⑵中混和气体V= L。
若2mol ZnFe2Ox与SO2可生成0.75mol S,x= 。则可分解⑵中混和气体V= L。
查看答案和解析>>
科目: 来源: 题型:
(12分)黄酮醋酸类化合物具有黄酮类化合物抗菌、消炎、降血压、保肝等多种生理活性和药理作用,尤其是近年来报道此类化合物具有独特抗癌活性。下面的方法采用对甲酚作为起始原料,通过一系列反应合成化合物黄酮F(化学式为C18H12O2NBr),为黄酮醋酸的前体化合物)。其进一步水解即得黄酮醋酸。合成路线如下:
对于F,分子中存在3个六元环,E和F在化学式上相差2个H原子。
⑴ 请画出A、D、F的结构简式
A 、D 、F ;
⑵ B有多种同分异构体,请写出一种含苯环、羰基和一个手性碳原子的同分异构体:
。
⑶ A可能发生的化学反应的类型有 。(写出二种)
⑷ 化合物![]() 的系统名称是 。
的系统名称是 。
⑸ D经过水解后的产物可通过缩聚反应生成高分子化合物,写出该缩聚反应的方程式 。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(12分)七水硫酸镁(MgSO4?7H2O)为白色细小四角柱状结晶,无臭,味苦,在干燥空气中易风化,易溶于水,缓溶于甘油,微溶于乙醇,热至68℃以上熔化。在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣――硼镁泥可制取七水硫酸镁。
表1 硼镁泥的主要化学成分
成分 | MgO | SiO2 | Fe2O3 | CaO | B2O3 | Al2O3 | MnO | CO2 |
质量分数% | 25-38 | 18-25 | 6-15 | 1-3 | 1-2 | 1-2 | 1-2 | 15-20 |
表2 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
硼镁泥制取七水硫酸镁的工艺流程如下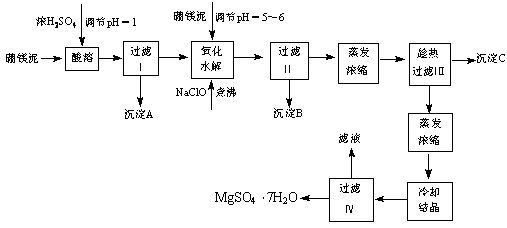
根据以上流程图并参考表格数据,试回答下列问题:
⑴ 硼镁泥是硼镁矿生产硼砂(Na2B4O7?10H2O)时的废渣。将硼镁矿(2MgO?B2O)锻烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应, 试写出反应方程式: 。
⑵ 沉淀A中除二氧化硅外,还含有硼酸,硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式 。
⑶ CaSO4的溶解度随温度升高变化不明显,在得到沉淀C时,对蒸发浓缩后的溶液却要进行趁热过滤,原因是 。
⑷ 经对沉淀B进行分析,发现其中含有二氧化锰,用方程式解释原因: 。
⑸ 用正三辛胺(TOA)做萃取剂,磺化煤油做稀释剂,通过有机萃取也可以用来除去硫酸镁浸出液中的铁。其主要反应如下:
Fe2++H2O=Fe(OH)2++H+ ⑴
Fe(OH)2++SO42-=Fe(OH)SO4 ⑵
2R3N+H2SO4=(R3NH)2SO4 ⑶
Fe(OH)SO4+(R3NH)2SO4=Fe(OH)SO4?(R3NH)2SO4 ⑷
试问:浸出液初始pH须加H2SO4调至0.9左右,pH>1.5时不利于萃取。试给出须加H2SO4的两个理由
![]() 。
。
![]() pH<0.5亦不利于萃取,给出其主要原因
pH<0.5亦不利于萃取,给出其主要原因 ![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
(8分)A物质是实验室一种五色有毒的挥发性液体,由X、Y两种短周期元素组成。A在空气中极易着火生成B气体和C气体,且反应前后总体积几乎不变;A不溶于水,但加热到423K可以和水反应,生成B气体和D气体,D有臭鸡蛋气味,只含两种元素,其中一种是Y。在交流放电的情况下,A分解生成E气体、F固体两种物质,E物质和B化学式量几乎相等,含Y元素约72.7%;F是环状单质分子,具有冠状结构,易溶于A,F的式量约是C的4倍。
![]() ⑴ 写出结构简式。
⑴ 写出结构简式。
![]() A 、B 、C 、D 、E 、F 。
A 、B 、C 、D 、E 、F 。
![]() ⑵ 自发现富勒烯以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究。厦门大学化学系对F物质的原子团簇进行了理论计算,发现除了冠状结构外还有多种结构。其中一种F1结构中一配位和三配位原子数目相等;另外一种F2是一种椅式结构原子团簇增加2个原子形成,F1、F2都是F的同分异构体。请画出这两种结构的原子团簇。
⑵ 自发现富勒烯以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究。厦门大学化学系对F物质的原子团簇进行了理论计算,发现除了冠状结构外还有多种结构。其中一种F1结构中一配位和三配位原子数目相等;另外一种F2是一种椅式结构原子团簇增加2个原子形成,F1、F2都是F的同分异构体。请画出这两种结构的原子团簇。
查看答案和解析>>
科目: 来源: 题型:
(10分)菠菜是常见蔬菜,100g菠菜中含有的营养成分为:草酸0.2-0.3g,水91.2g,蛋白质2.6g,脂肪0.3g,纤维素1.7g,糖类2.8g,维生素B1 0.04mg,维生素B2 0.11mg,维生素C 32mg,维E 1.74mg,Fe 2.9mg,Se 0.97g,胡萝卜素2.92mg,视黄醇0.487mg等。
⑴ 菠菜中铁的主要存在价态是 。
⑵ 验证菠菜中草酸的存在要先把草酸从菠菜中分离出来,然后利用钙离子将草酸从溶液中以沉淀(A)的形式分离,过滤后用酸重新溶解、蒸发、结晶(B)。沉淀A的化学式是 。
⑶ 结晶B在热天平差热分析联用的仪器中加热,测得在0-120℃、120-450℃、450-800℃三区间失重率之比为9:14:22,确定B的化学式 ,写出三个区间分解反应方程式 。
⑷ 定量测定结晶中B的含量:取结晶固体0.1280g加入0.2mol/L 盐酸15mL(用量筒量取),使固体全部溶解,然后用0.0200mol/L 的KMnO4溶液滴定,至锥形瓶中紫色不褪,用去KMnO4溶液16.20mL。计算结晶中B百分含量 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com