
科目: 来源: 题型:
化学概念在逻辑上存在如下关系:
 | |||||
包含关系 并列关系 交叉关系
对下列概念的说法正确的是
A.纯净物与混合物属于包含关系 B.化合物与碱性氧化物属于包含关系
C.单质与化合物属于交叉关系 D.氧化还原反应与分解反应属于并列关系
查看答案和解析>>
科目: 来源: 题型:
(14分)HNO3是极其重要的化工原料。工业上制备HNO3采用NH3催化氧化法,将中间产生的NO2在密闭容器中多次循环用水吸收制备的。(1)工业上用水吸收二氧化氮生产硝酸,生成的气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失)。
① 试写出上述反应的化学方程式。
② 设循环操作的次数为n,试写出NO2→HNO3转化率与循环操作的次数n之间关系的数学表达式。
③ 计算一定量的二氧化氮气体要经过多少次循环操作,才能使95%的二氧化氮转变为硝酸?
(2) 上述方法制备的HNO3为稀硝酸,将它用水稀释或蒸馏、浓缩可制得不同浓度的HNO3。实验证明:不同浓度的HNO3与同一金属反应可生成不同的还原产物。例如,镁与硝酸反应实验中,测得其气相产物有H2、N2、NO、NO2,液相产物有Mg(NO3)2,NH4NO3和H2O。生成这些产物的HNO3浓度范围为:H2:c<6.6 mol/L;N2和NH4+:c<10 mol/L;NO:0.1 mol/L<c<10 mol/L;NO2:c>0.1 mol/L。各气相产物成分及含量随HNO3浓度变化曲线如下图所示。
④ 写出Mg与11 mol/L的HNO3反应的方程式;
⑤ 960 mg Mg与一定体积4 mol/L的HNO3恰好完全反应,收集到224 mL气体(S.T.P)气体,试通过计算写出反应方程式。
查看答案和解析>>
科目: 来源: 题型:
(8分)a克镁在盛有b升(标况)CO2和O2混和气体的密闭容器中燃烧
(1) 写出在密闭容器中可能发生化学反应式:
(2)若反应容器中CO2有剩余,则容器内的固体物质一定含有 (填化学式)。
(3)若反应容器中O2有剩余,则容器内固体物质的质量为 克,此时,在b升CO2和O2的混和气中氧气体积必须满足的条件是 。
(4)若反应容器中无气体剩余,则容器内固体物质的质量(m)的取值范围为 ,并说明理由(要求写出推导过程)。
查看答案和解析>>
科目: 来源: 题型:
(12分)虽然分子中同一碳原子同时连接两个OH的化合物容易失水成为羰基(C=O)而无法分离,但是,一个碳原子同时连两个OR基或一个OR、一个OH基的化合物(称作缩醛、半缩醛)却是可以存在的。
RCHO+H2O![]() RCH(OH)2 不稳定
RCH(OH)2 不稳定
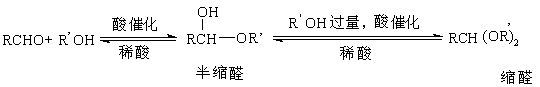
(在碱中稳定,可以分离出来)
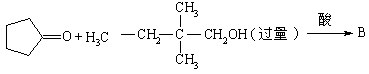
请写出下列反应式中A、B、C、D、E的结构式
(1) 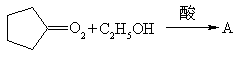
(2) 
(3)  b
b
(4) D(C6H12O3) ![]() 3CH3CHO
3CH3CHO
(5) E(C9H18O3) ![]() CH3CH2COOH+CH3CH2CHO+CH3CH2CH2OH
CH3CH2COOH+CH3CH2CHO+CH3CH2CH2OH
A: B: C:
D: E:
查看答案和解析>>
科目: 来源: 题型:
(8分) 2001年诺贝尔化学奖被美国的诺尔斯、夏普雷斯和日本的野依良治获得,他们发现了某些手性分子可用作某些化学反应的催化剂,为合成对人类有用的重要化学物开辟了一个全新的研究领域。在有机物分子中,若某个碳原子连接4个不同的原子或基团,则这种碳原子称为“手性碳原子”,如: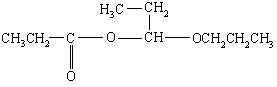 。若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在。某链烃C7H10。的众多同分异构体中:
。若同一个碳原子上连着2个碳碳双键(如C=C=C)时,分子极不稳定,不存在。某链烃C7H10。的众多同分异构体中:
(1) 处于同一平面上的碳原子数最多有 个。
(2) 含有“手性碳原子”,且与足量H2发生加成反应后仍具有“手性碳原子”的有多种。它们的结构简式除2种外,再写出3种
![]() 、
、![]()
 、 。
、 。
(3) 含有“手性碳原子”,但与足量H2发生加成反应后,不具有“手性碳原子”的结构简式是 。
查看答案和解析>>
科目: 来源: 题型:
(10分) 根据框图回答下列问题:

(1) 下列物种的化学式为:A ,B ,C 。
(2) 完成下列变化的离子方程式
A(aq)![]() ……: ,
……: ,
B+ H2C2O4→ ……:
(3) A转化为C的产率为
(4) 为在工业上实现A全部转化成C,实用的方法是 ,总的化学方程式为 。
查看答案和解析>>
科目: 来源: 题型:
(6分)有A、B、C、D四种短周期元素。已知一个B原子的原子核受到a粒子的轰击得到一个A原子的原子核和一个C原子的原子核,又知C、D元素同主族,且能发生下面两个反应。
A、B 化合物 + B、C 化合物 ![]() B单质 + A、C 化合物
B单质 + A、C 化合物
A、D 化合物 + D、C 化合物 ![]() D单质 + A、C 化合物
D单质 + A、C 化合物
请回答:
(1) 比较B、C原子半径大小 ;画出D离子的结构示意图 。
(2) 分别写出上述两个反应方程式 ; 。
查看答案和解析>>
科目: 来源: 题型:
(8分)根据信息完成下列方程式。
(1) 化工厂为了检验输送氯气的管道是否漏气,用蘸有浓氨水的粗玻璃棒接近管道,根据是否有白烟产生来判断。用方程式表示其原理。
。
(2) FeSO4溶液在pH=2的硫酸溶液中,暴露在空气中是比较稳定的。如在该溶液中加入氧化亚铁硫杆菌后,大部分Fe2+离子可迅速转化成Fe3+(Fe3+是浸出硫化矿物的良好的出剂)。这一反应是细菌浸出矿物的重要反应之一,该反应方程式为:
。
(3) 四氢硼酸钠(NaBH4)是一种重要的广谱还原剂,写出它在碱性溶液中将Ru3+离子还原为金属的反应的离子方程式。
。
(4) 向KI和H2SO4的混合溶液中加入过氧化氢,放出大量不溶于水的无色气体,同时溶液呈棕黄色,可使淀粉变蓝。
。
查看答案和解析>>
科目: 来源: 题型:
(5分)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
键能/kJ?mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
 (1) 比较下列两组物质的熔点高低(填“>”或“<”)
(1) 比较下列两组物质的熔点高低(填“>”或“<”)
SiC Si; SiCl4_________SiO2
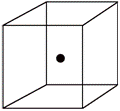
(2) 右图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(3) 工业上用高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g); 该反应的反应热△H= kJ/mol
Si(s)+4HCl(g); 该反应的反应热△H= kJ/mol
查看答案和解析>>
科目: 来源: 题型:
(6分)天然氟矿主要有萤石、氟磷灰石等。由萤石矿制F2的方法是先用浓硫酸与萤石反应,生成HF,再电解得F2。
(1) 给出由萤石矿制F2的主要化学反应的方程。
。
(2) 你认为用硫酸与萤石反应而不用盐酸的理由是什么?
。
(3) F-对人体的危害是很严重的。人体中若含有过多的F-,F-会与人体内一种重要的金属阳离子形成难溶物,而带给人体严重的伤害与痛苦,这种阳离子是: 。
(4) 请提出一种除去污水的过量的F-的方案,并给以简单的评价。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com