
科目: 来源: 题型:
环丙沙星(G)是一种新型的广谱抗菌药物,其工艺合成路线如下:

7-1 画出A、B、D、E、F的结构式。
7-2 为何由A转化为B需使用强碱NaH而由B转化为C的反应使用NaOC2H5即可?
7-3 由C转化为D是一步反应还是两步反应?简要说明之。
查看答案和解析>>
科目: 来源: 题型:
目标产物C(分子式C11H12O2)可通过如下合成路线合成:
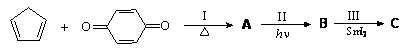
该合成路线涉及3个著名有机反应,分别举例介绍如下:
反应I是Diels-Alder反应:共轭双烯与烯烃或炔烃共热生成环已烯的衍生物,例如:
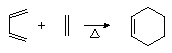
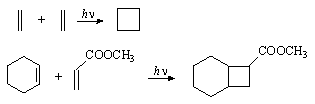
反应II是[2+2]环加成反应:在光照下两分子烯烃可双聚成环丁烷衍生物,举例如下;若分子内适当位置有2个C=C键,也有可能发生分子内的[2+2]环加成反应,
反应III是酮还原偶联反应,在二碘化钐等还原剂作用下两分子酮被还原并偶联生成相邻的二醇,例如:

6-1 画出A、B、C的结构式,请尽可能清楚地表达出它们的立体结构。
6-2 上述合成反应体现了哪些绿色化学的特征?
查看答案和解析>>
科目: 来源: 题型:
业已发现许多含金的化合物可以治疗风湿症等疾病,引起科学家广泛兴趣。在吡啶(![]() )的衍生物2,2'-联吡啶(代号A)中加入冰醋酸与30% H2O2的混合溶液,反应完成后加入数倍体积的丙酮,析出白色针状晶体B(分子式C10H8N2O2)。B的红外光谱显示它有一种A没有的化学键。B分成两份,一份与HAuCl4在温热的甲醇中反应得到深黄色沉淀C。另一份在热水中与NaAuCl4反应,得到亮黄色粉末D。用银量法测得C不含游离氯而D含游离氯7.18%。C的紫外光谱在211nm处有吸收峰,与B的213nm特征吸收峰相近,而D则没有这一吸收。C和D中金的配位数都是4。
)的衍生物2,2'-联吡啶(代号A)中加入冰醋酸与30% H2O2的混合溶液,反应完成后加入数倍体积的丙酮,析出白色针状晶体B(分子式C10H8N2O2)。B的红外光谱显示它有一种A没有的化学键。B分成两份,一份与HAuCl4在温热的甲醇中反应得到深黄色沉淀C。另一份在热水中与NaAuCl4反应,得到亮黄色粉末D。用银量法测得C不含游离氯而D含游离氯7.18%。C的紫外光谱在211nm处有吸收峰,与B的213nm特征吸收峰相近,而D则没有这一吸收。C和D中金的配位数都是4。
5-1 画出A、B、C、D的结构式。
5-2 在制备B的过程中加入丙酮起什么作用?
5-3 给出用游离氯测定值得出D的化学式的推理和计算的过程。查看答案和解析>>
科目: 来源: 题型:
超氧化物歧化酶SOD(本题用E为代号)是生命体中的“清道夫”,在它的催化作用下生命体代谢过程产生的超氧离子才不致过多积存而毒害细胞:
![]()
今在SOD的浓度为co(E) = 0.400X10-6 mol?L1,pH=9.1的缓冲溶液中进行动力学研究,在常温下测得不同超氧离子的初始浓度co(O2)下超氧化物歧化反应的初始反应速率ro如下:
co(O2)/mol?L1 | 7.69 X 106 | 3.33 X 105 | 2.00 X 104 |
ro/mol?L1?s1 | 3.85 X 103 | 1.67 X 102 | 0.100 |
3-1 依据测定数据确定歧化反应在常温下的速率方程r = k c(O2)n的反应级数。
3-2 计算歧化反应的速率常数k。要求计算过程。
3-3 在确定了上述反应的级数的基础上,有人提出了歧化反应的机理如下:
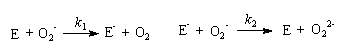
其中E为中间物,可视为自由基;过氧离子的质子化是速率极快的反应,可以不予讨论。试由上述反应机理推导出实验得到的速率方程,请明确指出推导过程所作的假设。
3-4 设k2 = 2k1,计算k1和k2。要求计算过程。
查看答案和解析>>
科目: 来源: 题型:
已知:原电池H2(g)| NaOH(aq) | HgO(s),Hg(l) 在298.15K下的标准电动势Ey=0.926V
反应H2(g) + 1/2 O2(g) = H2O(l) rGmy(298K) = 237.2kJ?mol1
物 质 | Hg(l) | HgO(s) | O2(g) |
Smy(298K)/J?mol1?K1 | 77.1 | 73.2 | 205.0 |
2-1写出上述原电池的电池反应与电极反应(半反应)。
2-2计算反应HgO(s)=Hg(l) + ½ O2(g) 在298.15K下的平衡分压p(O2)和rHmy(298.15K)。
2-3设反应的焓变与熵变不随温度而变,求HgO固体在空气中的分解温度。
查看答案和解析>>
科目: 来源: 题型:
A的单质和B的单质在常温下激烈反应,得到化合物X。X的蒸气密度是同温度下的空气密度的5.9倍。X遇过量水激烈反应,反应完全后的混合物加热蒸干,得一难溶物,后者在空气中经1000oC以上高温灼烧,得到化合物Y。Y在高温高压下的一种晶体的晶胞可与金刚石晶胞类比,A原子的位置相当于碳原子在金刚石晶胞中的位置,但Y晶胞中A原子并不直接相连,而是通过E原子相连。X与过量氨反应完全后得到含A的化合物Z。Z经高温灼烧得化合物G。G是一种新型固体材料。
1-1 写出X的化学式。1-2 写出Y的化学式。1-3 写出Z的化学式。
1-4 写出G的化学式。1-5 你预计G有什么用途?用一两句话说明理由。
查看答案和解析>>
科目: 来源: 题型:
19世纪丹麦学者尤利乌斯?托姆森得到一个计算CuCI2?2H2O在水中溶解热效应(△H)的式子,当所得溶液中每1 mol CuCl2有x mol水时,所产生的热效应△H=[3. 35一21. 02× (x一10)/( x+11.24) ]kJ (△H<0,表明反应放热,△H>0,表明反应吸热![]() 。2 0 °C时(此时饱和溶液中每l00 g水含无水氯化铜74. 5g), 每摩尔氯化铜溶解的热效应与
。2 0 °C时(此时饱和溶液中每l00 g水含无水氯化铜74. 5g), 每摩尔氯化铜溶解的热效应与 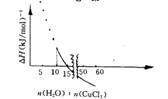 所形成饱和溶液中含水量的关系如下图所示
所形成饱和溶液中含水量的关系如下图所示
x = n(H2O)n(CuCl2)
则下列叙述不正确的是
A.仅根据题目所给信息,无法算出2 0 °C时CuCl2饱和溶液的物质的量浓度
B.CuCl2?2H2O溶于水是放热的
C.在极稀的溶液中,即当x趋向无穷大时,1 mol氯化铜溶解时放出17.67 kJ热量
D.当x<10时,因CuCI2不能完全溶解,上图无物理意义
查看答案和解析>>
科目: 来源: 题型:
FeS能跟盐酸反应生成H2S气体和FeCl2。把8.8g FeS 放入200 mL 2.0 mol/L 的盐酸中,以制备H2S。反应完全后,若溶液中H2S的浓度为0.1 mol/L,假定溶液体积不变,则下列叙述不正确的是
A.理论上可收集到H2S气体1.792L
B.反应后溶液中c(Fe2+)= 0.5 mol/L
C.反应后溶液中c(Fe3+)= 0.5 mol/L
D.反应后溶液中c(H+)= 1 mol/L
查看答案和解析>>
科目: 来源: 题型:
将一定量的锌与100mL 18.5 mol/L 的浓硫酸充分反应后,锌完全溶解,同时生成气体A 16.8L (标准状况),将反应后所得溶液稀释至1L ,测得其c(H+)为1 mol/L,则下列叙述中错误的是
A.气体A 为SO2和H2的混合物 B.气体A 中SO2和H2的体积比为4:1
C.反应共消耗掉锌95.5g D.反应中共转移电子1.5 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com