
科目: 来源: 题型:
(9分)20世纪60年代,化学家发现了一类酸性比100%的硫酸还要强的酸,称之为魔酸,其酸性强至可以将质子给予δ受体,CF3SO3H就是其中常见的魔酸之一。
9-1 试写出CH3CH3与CF3SO3H可能的反应式。
9-2 以上反应所得产物活性均很高,立即发生分解,试写出分解以后所得到的全部可能产物。
查看答案和解析>>
科目: 来源: 题型:
(8分)近年来,化学家将F2通入KCl和CuCl的混合物中,制得了一种浅绿色的晶体A和一种黄绿色气体B。经分析,A有磁性,其磁矩为μ=2.8B.M,且能被氧化。将A在高温高压下继续和F2反应,可得C,C的阴离子和A的阴离子共价键数不变(阴离子结构对称)。已知A、C中铜元素的质量分数分别为21.55%和24.85%。
8-1 试写出A~C的化学式,分别指出A、C中铜的化合价和价电子构型。
8-2 写出上述化学反应方程式。
8-3 简述A、C阴离子形成的原因。
查看答案和解析>>
科目: 来源: 题型:
(12分)2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的一种重复单位如右图所示。镁原子间形成正六棱柱,六个硼原子位于棱柱内。
7-1 则该化合物的化学式可表示为 ;
7-2 画出该晶体的晶胞示意图(Mg原子在晶胞的顶点);
7-3 Mg原子的配位数是 ,B原子的配位数是 ;
7-4 B原子的空间排列方式与 (物质名称)的排列方式类似;并判断Mg、B在平面片层的排列是否为最密排列。
7-5 如果将B原子画在晶胞的顶点,在右框中画出此时晶胞的示意图;
7-6 上述所画两个晶胞的体积比是 。
查看答案和解析>>
科目: 来源: 题型:
(6分)合成氨工业中,原料气(N2,H2及少量CO,NH3的混合气)在进入合成塔前常用[Cu(NH3)2]Ac溶液来吸收原料气中的CO,其反应为:
[Cu(NH3)2]Ac+CO+NH3 ![]() [Cu(NH3)3]Ac?CO+Q
[Cu(NH3)3]Ac?CO+Q
6-1 命名:[Cu(NH3)2]Ac
6-2 必须除去原料气中的CO的原因是 ;
6-3 [Cu(NH3)2]Ac吸收CO的生产适宜条件应是 ;
6-4 吸收CO的[Cu(NH3)2]Ac溶液经适当处理后又可再生,恢复其CO的吸收能力以供循环使用,[Cu(NH3)2]Ac再生的适宜条件是 。
查看答案和解析>>
科目: 来源: 题型:
(11分)卡宾又称为碳烯,是某些有机反应的中间物质,碳原子最外层有两个电子没有参与成键。由于其结构的特殊 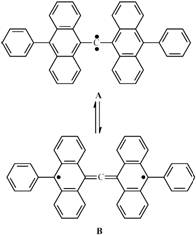 性,所以有很高的活性。卡宾主要分单线态和三线态两种状态,三线态稳定性最差。然而,2001 年Nature 杂志报道了日本研究人员偶然获得了迄今为止最稳定的三线态卡宾(如图,实心圆点表示电子),其在室温溶液中半衰期高达19 分钟,比1999 年报道的最长半衰期三线态卡宾的半衰期长10 分钟。三线态对于形成铁磁性有机材料具有潜在意义,故该偶然发现有可能导致新的有机磁性材料。
性,所以有很高的活性。卡宾主要分单线态和三线态两种状态,三线态稳定性最差。然而,2001 年Nature 杂志报道了日本研究人员偶然获得了迄今为止最稳定的三线态卡宾(如图,实心圆点表示电子),其在室温溶液中半衰期高达19 分钟,比1999 年报道的最长半衰期三线态卡宾的半衰期长10 分钟。三线态对于形成铁磁性有机材料具有潜在意义,故该偶然发现有可能导致新的有机磁性材料。
回答下列问题:
5-1 合成中重要的碳烯是二氯卡宾(CCl2),请分析其具有高反应活性的原因。
5-2 右图中A 的化学式为___________________
5-3 分子B中所有苯环是否会共平面,为什么?
5-4 比较A和B的稳定性,并说明可能的原因。
查看答案和解析>>
科目: 来源: 题型:
(12分)钢铁表面发蓝(或发黑,在钢铁表面形成一层致密的氧化物Fe3O4)可提高其耐磨、耐蚀性能。其原理是:
①在NaOH溶液中,将铁粉溶解在NaNO2溶液中,除水之外,还可产生A和C。其中C为气体,能使湿润的红色石蕊试纸变蓝。
②A能在过量的NaNO2溶液中继续反应,生成B和C。
③A和B的溶液能继续反应,生成Fe3O4。
经研究发现:A和B的焰色反应均为黄色,其导电性实验均为K2SO4型。生成物中A与C、B与C的物质的量之比均为31。回答下列问题:
4-1 写出并配平化学反应方程式。
4-2 实践中发现适当提高温度或增大NaNO2溶液的浓度有利于氧化膜增厚,但加大NaOH溶液浓度对膜层厚度影响不大。试说明原因。
4-3 发蓝层遇光气(COCl2),若不及时清洗,则发蓝层的完整性将被破坏。写出有关的化学反应方程式。
4-4 有一种隐形材料D可由B与Zn(NO3)2 反应生成,也可用以硝酸铁、硝酸锌、氢氧化钠等为原料的水热合成法。请确定D的化学式,并判断上述制备D的反应是否属于氧化还原反应。此法所得产品D能够隐形的原因是什么?
查看答案和解析>>
科目: 来源: 题型:
(11分)上世纪末,中国科大的化学家把CCl4(l)和Na混合放入真空容器中,再置于高压容器中逐渐加热,可得一些固体颗粒。经X-射线研究发现:该固体颗粒实际由A和B两种物质组成,其中A含量较少,B含量较多。试回答下列问题:
2-1 CCl4和Na为何要放在真空容器中?随后为何要置于高压容器中?
2-2 指出CCl4分子的结构特点和碳原子的杂化态。
2-3 上述实验的理论依据是什么?请从化学反应的角度加以说明。
2-4 试确定A、B各为何物?A、B之间有何关系?
2-5 写出上述反应方程式,并从热力学的角度说明A为何含量较少,B为何含量较多?
2-6 请你从纯理论的角度说明:采取什么措施后,A的含量将大幅度增多?
2-7 请评述一下上述实验有何应用前景?
查看答案和解析>>
科目: 来源: 题型:
(8分)根据提供的信息写出相应的化学方程式:
1-1 据认为“红巨星”星体内部发生着合成重元素的中子俘获反应,例如![]() Zn可以俘获1个中子形成A,过剩的能量以光子形式带走;A发生β衰变转化为B。
Zn可以俘获1个中子形成A,过剩的能量以光子形式带走;A发生β衰变转化为B。
试写出平衡的核反应方程式。
1-2 铍与某些普通配体形成的配合物相当稳定,比如铍的化合物A为无色可升华的分子型化合物,易溶于氯仿并可从氯仿溶液中重结晶。A物质中心氧原子周围按四面体方式排布4个Be原子,Be原子两两间又被醋酸根所桥联。该物质可以通过碳酸铍与醋酸反应制备,请写出该制备反应的化学方程式;
1-3 ClF3是比F2更有效的氟化剂,遇有机物往往爆炸,能燃烧石棉,能驱除许多金属氧化物中的氧。比如气态ClF3与Co3O4反应,作为还原剂的元素有两种,物质的量之比为14,请写出反应方程式。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(10分)维生素C又称抗坏血酸,广泛存在于水果、蔬菜中,属于外源性维生素,人体不能自身合成,必须从食物中摄取。其化学式为C6H8O6,相对分子量为176.1,由于分子中的烯二醇基具有还原性,能被I2定量地氧化成二酮基,半反应为:
C6H8O6 = C6H6O6 + 2H+ + 2e j y = 0.18 V
因此,可以采用碘量法测定维生素C药片中抗坏血酸的含量。具体实验步骤及结果如下:
(1)准确移取0.01667 mol/L的K2Cr2O7标准溶液10.00 mL于碘量瓶中,加3 mol/L H2SO4溶液10 mL,10% KI溶液10 mL,塞上瓶塞,暗处放置反应5 min,加入100 mL水稀释,用Na2S2O3标准溶液滴定至淡黄色时,加入2 mL淀粉溶液,继续滴定至溶液由蓝色变为亮绿色。平行三次实验,消耗Na2S2O3标准溶液平均体积为19.76 mL。
(2)准确移取上述Na2S2O3标准溶液10.00 mL于锥瓶中,加水50 mL,淀粉溶液2 mL,用I2标准溶液滴定至蓝色且30 s不褪。平行三次实验,消耗I2标准溶液平均体积为10.15 mL。
(3)准确称取0.2205 g的维生素C粉末(维生素C药片研细所得)于锥瓶中,加新煮沸过并冷却的蒸馏水100 mL,2 mol/L HAc溶液10 mL,淀粉溶液2 mL,立即用I2标准溶液滴定至蓝色且30 s不褪,消耗12.50 mL。
(4)重复操作步骤(3),称取维生素C粉末0.2176 g,消耗I2标准溶液为12.36 mL;称取维生素C粉末0.2332 g,消耗I2标准溶液为13.21 mL。
根据以上实验结果计算出该维生素C药片中所含抗坏血酸的质量分数。
查看答案和解析>>
科目: 来源: 题型:
(8分)本题涉及4种组成不同的配合物,它们都是平面正方形结构。
9-1 PtCl2?2KCl的水溶液与二乙硫醚(Et2S)反应(摩尔比1:2)得到两种结构不同的黄色配合物,该反应的化学方程式和配合物的立体结构是:
9-2 PtCl2?2KCl的水溶液与足量Et2S反应获得的配合物为淡红色晶体,它与AgNO3反应(摩尔比1:2)得到两种组成不同的配合物,写出上述两个反应的化学方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com