
科目: 来源: 题型:
(9分)简答下列问题:
1-1 AsH3的分解是一级反应。将AsH3和AsD3的混合物分解可得到HD,但AsH3和D2的混合物的分解就得不到HD。这说明了
1-2 将Cl2通入到用冰冷却的AsF3中,可生成混合卤化物AsCl2F3,在过量的AsF3中能导电,说明了AsF3中,AsCl2F3存在 和 离子。相应的中心原子的杂化形态为 和 。
1-3 研究发现:有一种砷的氧化物的化学式为AsO2。你的解释是
1-4 光学实验表明:氧溶于水后有氧的水合物O2?H2O和O2?2H2O生成,其中后者较不稳定,则它们的结构简式分别为 和 。
已知氧气在水中的溶解度为氮气的2倍,考虑到空气中氮气和氧气的含量,得到空气溶于水后的氧气和氮气的体积比约为 。
查看答案和解析>>
科目: 来源: 题型:
12分)高支化聚合物是一种新型高分子材料,是21世纪高分子科学发展的重要方向之一。高支化聚合物包括树枝状聚合物和超支化聚合物两类,它们均具有良好的溶解性、低粘度和易于端基改性等特性。树枝状聚合物结构规整,但合成困难;超支化聚合物结构虽不完整,但合成相对简便,易于工业化。通常利用XYn(n≥2)型单体的自缩聚反应合成超支化聚合物,通过改变超支化聚合物的结构及对其端基进行修饰可以制备多种具有特殊用途的新材料,在高分子加工助剂、特种涂料与粘合剂、高性能复合材料、功能膜材料和药物控制释放等领域具有广泛的应用前景。
以XYn型单体A(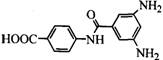 )为原料合成了一种超支化聚芳酰胺B,合成路线如下:
)为原料合成了一种超支化聚芳酰胺B,合成路线如下:
C(C7H3N2O5Cl)+D![]() E
E![]() A
A![]() B
B
8-1 写出C、D、E的结构简式
8-2 命名A和C
8-3 画出B(超支化聚芳酰胺)的有代表性的结构片段
8-4 B在水溶液和醇溶液中的溶解性如何?说明理由
8-5 通过原位端基改变,可制备多种封端的超支化聚合物。写出下面两个反应产物的结构简式
(1)A+乙酸酐 →
(2)A+苯甲酰氯 →
查看答案和解析>>
科目: 来源: 题型:
(11分)据最近的文献报道,以(Ph3P)2Cu(OOCCH2COOH)(式中Ph-为苯基)与正丁酸铜(Ⅱ)在某惰性溶剂中及氦气氛下反应1h,然后真空除去溶剂,得到淡紫色的沉淀物。该沉淀被重新溶解,真空干燥,如此反复4次,最后在CH2Cl2中重结晶,得到配合物A的纯品,产率为72%。元素分析:A含C(64.88%)、H(3.78%)、P(8.58%),不含氯。红外谱图显示,A中-COO-基团vCOO-(CH2C12中)有两个吸收峰:1633cm-1和1344cm-1,表明它只有单氧参与配位;核磁共振谱还表明A含有Ph-、-CH2-,不含-CH3基团,Ph的结合状态与反应前相同。单晶X射线衍射数据表明有两种化学环境的Cu(且配位数都是4),且A分子有很好的对称性。
7-1 写出配合物A的化学式。
7-2 写出配合物A生成的化学方程式。
7-3 淡紫色沉淀物被重新溶解,真空干燥,如此反复操作多次的目的是除去何种物质?
7-4 画出配合物A的结构式。
查看答案和解析>>
科目: 来源: 题型:
(4分) “瘦肉精”学名盐酸克仑特罗。用作饲料后,猪吃了它能减肥,人吃了它会中毒甚至死亡。自20世纪80年代开始,欧美等世界各国均将其定为禁用药品。
6-1 盐酸克仑特罗的化学名为α-[(叔丁氨基)甲基]一对氨基―3,5一二氯苯甲醇盐酸盐,化学式为C12H18Cl2N2O?HCl。画出它的结构简式。
6-2 在该结构简式上有*标出具有光学活性的原子,并比较它们的强弱。
查看答案和解析>>
科目: 来源: 题型:
 (11分)不久前,美国威斯康星洲Emory大学的研究者们发现了一种可以在温和条件下将硫醚(普通醚的氧原子被硫代替)选择性地氧化为硫氧化物的水溶性催化剂。新催化剂是金(III)配合物(如图),催化速度比已知以氧气为氧化剂的高温水溶性催化剂高几个数量级。该发现的潜在应用价值是可以在空气中分解掉化妆品、涂料、织物的污染物。回答下列问题:
(11分)不久前,美国威斯康星洲Emory大学的研究者们发现了一种可以在温和条件下将硫醚(普通醚的氧原子被硫代替)选择性地氧化为硫氧化物的水溶性催化剂。新催化剂是金(III)配合物(如图),催化速度比已知以氧气为氧化剂的高温水溶性催化剂高几个数量级。该发现的潜在应用价值是可以在空气中分解掉化妆品、涂料、织物的污染物。回答下列问题:
5-1 下列物质中属于硫醚的有( )。
A.CH3-SH B.CH3-S-CH3 C.CH3-![]() -CH3 D.CH3CH2-
-CH3 D.CH3CH2-![]() -OH
-OH
5-2 配位键是一种特殊的共价键,共享电子对完全由一个原子提供。该催化剂分子中的配位键是_____________。
5-3 “金(Ⅲ)配合物”中‘Ⅲ’表示_____________。
5-4 氧化硫醚的氧化剂一般选择过氧化氢,由于副产物是水,对环境十分友好,所以,过氧化氢被称为“绿色氧化剂”。
①过氧化氢与水比较:沸点较高的是________;密度较大的是________;常见分子中,与过氧化氢式量相同的分子是__________(填化学式)。
②过氧化氢可以看作二元弱酸,在低温、稀溶液状态下能较稳定地存在,其水溶液俗称双氧水。请设计一条实验室制备少量纯净的双氧水的合成路线(只写出原理即可)。
③HOF 是较新发现的一种特殊物质,该物质容易水解能得到有氧化性的酸性溶液。请写出该水解方程式________________________。
查看答案和解析>>
科目: 来源: 题型:
(9分)Ar、Xe、CH4、Cl2等分子能和水形成气体水合物晶体。在这种晶体中,水分子形成三维氢键骨架体系。在骨架中有空穴,它可以容纳这些气体小分子形成笼型结构。
4-1 甲烷的气体水合物晶体成为可燃冰。已知每1m3这种晶体能释放出164m3的甲烷气体。试估算晶体中水与甲烷的分子比。(不足的数据由自己假定,只要假设合理均按正确论)
4-2 X-射线衍射分析表明,该晶体属于立方晶系a=1200pm。晶胞中46个水分子围成两个五角十二面体和六个稍大的十四面体(2个六角形面,12个五角形面),八个CH4分子可以进入这些多面体笼中。计算甲烷和水的分子数之比和该晶体的密度。
4-3 已知Cl2的气体水合物晶体中,Cl2和H2O的分子数之体为18,在其晶体中水分子所围成的笼型结构与可燃冰相同。推测它的结构。
查看答案和解析>>
科目: 来源: 题型:
(11分)化合物A含硫(每个分子只含1个硫原子)、氧以及一种或几种卤素;少量A与水反应可完全水解而不被氧化或还原,所有反应产物均可溶于水;将A配成水溶液稀释后分成几份,分别加入一系列0.1 mol/L的试剂,现象如下:
①加入硝酸和硝酸银,产生微黄色沉淀。
②加入硝酸钡,无沉淀产生。
③用氨水将溶液调至pH=7,然后加入硝酸钙,无现象发生。
④溶液经酸化后加入高锰酸钾,紫色褪去,再加入硝酸钡,产生白色沉淀。
⑤加入硝酸铜,无沉淀。
3-1 ①、②、③的目的是为了检出什么离子?试分别写出欲检出离子的化学式。
3-2 写出④发生的反应的离子方程式。
3-3 ⑤的欲测物质是什么?写出欲测物质与加入试剂的离子方程式。
3-4 以上测试结果表明A可能是什么物质?写出 A的化学式。
3-5 称取7.190g A溶于水稀释至250.0cm3。取25.00cm3溶液加入HNO3和足量的AgNO3,使沉淀完全,沉淀经洗涤、干燥后称重,为1.452g。写出A的化学式。
3-6 写出A与水的反应的方程式。若你未在回答以上问题时得到A的化学式,请用SO2ClF代替A。
查看答案和解析>>
科目: 来源: 题型:
(13分)金属X被喻为“含在口中就熔化的金属”,是1871年俄国化学家门捷列夫在编制化学元素周期表时曾预言的“类铝”、1875年法国化学家布瓦博德朗从闪锌矿中离析出的金属。近年来,X成为电子工业的新宠,其主要用途是制造半导体材料,被誉为“半导体材料的新粮食”。
2-1 X的元素符号是 ,电子构型是 。呈现的化合价可能是 和 。
2-2 X的化学性质不活泼,在常温下几乎不与氧和水发生反应,但溶于强酸和强碱。写出离子反应方程式。
2-3 X的熔点为 (请估计),沸点却高达2403℃,更奇妙的是X有过冷现象(即熔化后不易凝固),它可过冷到-120℃,是一种低熔点、高沸点的液态范围最大的金属,是金属制造 材料中的千古绝唱。
并分析X做该材料时还可能具有哪些性质 。
2-4 X不能像普通金属那样任意堆放,也不能盛装在玻璃容器内,试分析可能原因,并提出保存方案。
查看答案和解析>>
科目: 来源: 题型:
(6分)完成下列化学方程式
1-1 某校曾发生误将高锰酸钾与红磷相混,造成一死一残的严重事故。试写出这一变化的化学方程式。
1-2 在一支试管中,盛少量As2S3和K2S粉末(物质的量之比为12),往其中加入足量硝酸并微热。写出化学反应方程式(用一个化学方程式表示,HNO3还原为NO)
1-3 在SnCl2的硫酸溶液中滴入KMnO4至刚好反应完全。写出离子反应方程式。
查看答案和解析>>
科目: 来源: 题型:阅读理解
(11分)1866年H. Rithausen从谷胶的硫酸分解产物中分离出谷氨酸(![]() )。1890年L. Wollf合成并确定了它的结构,1908年池田菊苗从海带的热水提取物中分离出谷氨酸的钠盐(
)。1890年L. Wollf合成并确定了它的结构,1908年池田菊苗从海带的热水提取物中分离出谷氨酸的钠盐(![]() ),它才是具有鲜味的成分,即味精。
),它才是具有鲜味的成分,即味精。
10-1 谷氨酸的电离常数Ka1=6.46×10-3,Ka2=5.62×10-5,Ka3=2.14×10-10;pKa= -lgKa,所以pKa1=2.19,pKa2 = 4.25,pKa3 = 9.67。
目前工业上生产味精的方法有水解法、糖蜜提取法、淀粉发酵法及合成法等。当前我国生产的味精主要采用淀粉发酵法。
以发酵法生产的工艺流程如下:淀粉![]() 葡萄糖
葡萄糖![]() 发酵
发酵![]() 谷氨酸铵
谷氨酸铵![]() L-谷氨酸
L-谷氨酸![]() 谷氨酸-钠盐。
谷氨酸-钠盐。
若生成谷氨酸二钠盐,则不具有鲜味,所以工业生产中控制各阶段的pH是一项关键。
(1)Ka1、Ka2、Ka3相对应的基团各是哪个?
(2)计算谷氨酸等电点的pH(所谓等电点,就是谷氨酸呈电中性时所处环境的pH)。在下面正确的选项上画圈。
A.2.19 B.3.22 C.4.25 D.6.96
(3)中和、脱色、结晶时的pH应保持在多少?在下面正确的选项上画圈。
A.3.22 B.4.25 C.6.96 D.9.67
(4)用什么物质脱色?
10-2 味精中有效成分是谷氨酸钠,可用沙伦逊甲醛滴定法测定其含量。准确称取味精1.000g,加蒸馏水溶解后稀释到10.0mL;从中取2.0mL放入100mL锥形瓶中,加入2.0mL 36%的甲醛溶液,加入20mL水。以酚酞为指示剂,用0.1000mol/L的标准NaOH溶液进行滴定,消耗10.80mL。
(1)谷氨酸钠与甲醛反应得到化学式为C6H8NO4Na,写出结构简式。
(2)加入甲醛的目的是什么?
10-3 味精中往往会加入食盐,某学生设计如下实验方案测定NaCl含量:取味精样品5.0g,并溶于蒸馏水;加入足量用稀硝酸酸化的硝酸银溶液,使沉淀完全;过滤;用蒸馏水反复洗涤沉淀多次;将沉淀低温烘干、称量;重复操作3次,计算NaCl含量。
另一学生觉得这个实验方案的误差较大,且测定沉淀的质量很不方便。于是他设计了另一个实验方案来测定NaCl的含量。已知AgSCN是难溶于水的沉淀。
请简要写出测定NaCl含量的新方案。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com