
科目: 来源: 题型:
A.NO:0.001 mol·L-1 B.H2O:0.002 mol·L-1
C.NH3:0.002 mol·L-1 D.O2:0.001 25 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
编号 | 金属(粉末状) | 酸的浓度及体积 | 反应温度 |
A | Mg:0.1 mol | 6 mol·L-1 HNO3 10 mL | 60 ℃ |
B | Mg:0.1 mol | 3 mol·L-1HCl 10 mL | 60 ℃ |
C | Fe:0.1 mol | 3 mol·L-1HCl 10 mL | 60 ℃ |
D | Mg:0.1 mol | 3 mol·L-1H2SO4 10 mL | 60 ℃ |
查看答案和解析>>
科目: 来源: 题型:
A.反应速率不变,Z的产量减少 B.反应速率增大,Z的产量减少
C.反应速率增大,Y的转化率降低 D.反应速率减小,Z的产量增大
查看答案和解析>>
科目: 来源: 题型:
A.都增大 B.都减小
C.v1增大,v2减小 D.v1减小,v2增大
查看答案和解析>>
科目: 来源: 题型:
①活化分子间的碰撞一定能发生化学反应 ②普通分子间的碰撞有时也能发生化学反应③活化分子比普通分子具有较高的能量 ④化学反应的实质是原子的重新组合 ⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程 ⑥化学反应的实质是活化分子有合适取向时的有效碰撞
A.①③④⑤ B.②③⑥ C.③④⑤⑥ D.②④⑤
查看答案和解析>>
科目: 来源: 题型:
回答下列问题:
(1)你认为减少酸雨的产生可采取的措施是( )
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新的能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤
(2)用传统的煤、石油作燃料,其主要缺点是什么?
_____________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
(1)在高温下碳与水反应生成一氧化碳和氢气:C+H2O![]() CO+H2
CO+H2
(2)一氧化碳和氢气燃烧放出的热量总和比碳燃烧放出的热量多:
C(s)+O2(g)![]() CO2(g) ΔH=-393.51 kJ·mol-1
CO2(g) ΔH=-393.51 kJ·mol-1
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-242 kJ·mol-1
H2O(l) ΔH=-242 kJ·mol-1
CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=-283 kJ·mol-1
CO2(g) ΔH=-283 kJ·mol-1
因此该同学得出结论“煤炭燃烧时加少量水,可使煤炭燃烧放出更多的热量。”你认为该同学的结论是否正确?请简要说明理由。
_____________________________________________________________________
查看答案和解析>>
科目: 来源: 题型:
H2(g)+ ![]() O2(g)
O2(g)![]() H2O(l) ΔH=-285 kJ·mol-1
H2O(l) ΔH=-285 kJ·mol-1
C3H8(g)+5O2(g)![]() 3CO2(g)+4H2O(l) ΔH=-2 220.0 kJ·mol-1
3CO2(g)+4H2O(l) ΔH=-2 220.0 kJ·mol-1
(1)实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6264.5 kJ,则混合气体中H2和C3H8的体积比是__________。
(2)已知H2O(l)![]() H2O(g) ΔH=+44.0 kJ·mol-1
H2O(g) ΔH=+44.0 kJ·mol-1
写出丙烷燃烧生成CO2和气态水的热化学方程式。
_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
a.利用煤在充足的空气中直接燃烧产生的反应热;b.先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
a.C(s)+O2(g)![]() CO2(g) ΔH=E1 ①
CO2(g) ΔH=E1 ①
b.C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=E2 ②
CO(g)+H2(g) ΔH=E2 ②
H2(g)+![]() O2(g)
O2(g)![]() H2O(g) ΔH=E3 ③
H2O(g) ΔH=E3 ③
CO(g)+![]() O2(g)
O2(g)![]() CO2(g) ΔH=E4 ④
CO2(g) ΔH=E4 ④
回答:
(1)与途径a相比途径b有较多的优点,即__________。
(2)上述四个热化学方程式中的哪个反应ΔH>0?_______。
(3)等质量的煤分别通过以上两条不同的途径产生的可利用的总能量关系正确的是( )
A.a比b多 B.a比b少 C.a与b在理论上相同
(4)根据能量守恒定律,E1、E2、E3、E4之间的关系为__________。
查看答案和解析>>
科目: 来源: 题型:
(1)a、b 、c分别代表什么意义?
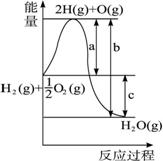
a.__________;b. __________;c. __________。
(2)该反应是放热还是吸热?__________。ΔH大于零还是小于零?__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com