
科目: 来源: 题型:
甲:①称取一定量的HA配制成0.1 mol·L-1的溶液100 mL;
②用pH试纸测出该溶液的pH,即可证明HA是弱电解质。
乙:①用已知物质的量浓度的HA溶液、盐酸溶液,分别配制pH=1的两种酸溶液各100 mL;
②分别取这两种溶液各10 mL,加水稀释为100 mL;
③各取相同体积的两种稀释液装入两支试管,同时加入纯度和大小相同的锌粒,观察现象,即可证明HA是弱电解质。
(1)在甲、乙两个方案的①中,都要用到的定量仪器是___________。
(2)甲方案中,证明HA是弱电解质的理由是测得溶液的pH_______1(选填“>”“<”或“=”)。乙方案中,说明HA是弱电解质的现象是______________。
A.装盐酸溶液的试管中放出H2的速率快
B.装HA溶液的试管中放出H2的速率快
C.两支试管中产生气体的速率一样快
(3)请你评价:乙方案中难以实现之处和不妥之处:_____________________。
(4)请你再提出一个合理而比较容易进行的方案(药品可任取),作简明扼要表述:_____________________。
查看答案和解析>>
科目: 来源: 题型:
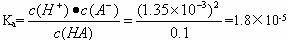
(1)恰好完全中和时(B点)溶液的pH_______7(填“>”“<”或“=”),理由是______________。
(2)当弱电解质AB在水溶液里达到平衡时:AB![]() A++B-,即有K电离=
A++B-,即有K电离=![]()
式中c(A+)·c(B-)、c(AB)分别表示粒子A+、B-、AB电离平衡时的物质的量浓度,K电离是弱电解质的电离平衡常数,简称电离常数,一定温度下,电离常数不随溶液浓度改变而改变,通过上述材料的阅读,求本题中一元弱酸的电离常数。
(3)求A点的pH。(lg1.35=0.13 lg1.8=0.26)
查看答案和解析>>
科目: 来源: 题型:
甲同学的解释是:
Mg(OH)2(s)![]() Mg2++2OH- ①
Mg2++2OH- ①
![]() +H2O
+H2O![]() NH3·H2O+H+ ②
NH3·H2O+H+ ②
H++OH-![]() H2O ③
H2O ③
由于![]() 水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解。
水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2(s)![]() Mg2++2OH- ①
Mg2++2OH- ①
![]() +OH-
+OH-![]() NH3·H2O ②
NH3·H2O ②
由于NH4Cl电离出的![]() 与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①平衡右移,沉淀溶解。
与Mg(OH)2电离出的OH-结合,生成了弱电解质NH3·H2O,导致反应①平衡右移,沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由_____________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的悬浊液中,Mg(OH)2溶解,由此推知:甲和乙哪位同学的解释更合理_________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
(1)为了验证上述哪种解释正确,继续做如下实验,向0.1 mol·L-1的醋酸溶液中加入少量下列物质中的__________(填写编号),然后测定溶液的pH。
A..固体CH3COOK B.固体CH3COONH4
C.气体NH3 D.固体NaHCO3
(2)若________(填“甲”或“乙”)的解释正确,溶液的pH应________(填“增大”“减小”或“不变”)。(已知:25 ℃时,NH3·H2O的Ka=1.8×10-5,CH3COOH的Kb=1.8×10-5)
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.c(![]() )=c(Na+)>c(OH-)>c(H+)
)=c(Na+)>c(OH-)>c(H+)
C.c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)
)+c(H2CO3)
D.c(OH-)=c(![]() )+2c(H2CO3)+c(H+)
)+2c(H2CO3)+c(H+)
查看答案和解析>>
科目: 来源: 题型:
A.c(![]() )>c(OH-)>c(
)>c(OH-)>c(![]() )>c(Ba2+)
)>c(Ba2+)
B.c(![]() )>c(Ba2+)>c(OH-)>c(
)>c(Ba2+)>c(OH-)>c(![]() )
)
C.c(Ba2+)>c(![]() )>c(OH-)>c(
)>c(OH-)>c(![]() )
)
D.c(![]() )>c(Ba2+)>c(
)>c(Ba2+)>c(![]() )>c(OH-)
)>c(OH-)
查看答案和解析>>
科目: 来源: 题型:
A.c(Cl-)>c(![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c(Cl-)>c(H+)>c(![]() )>c(OH-)
)>c(OH-)
C.c(Cl-)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.c(OH-)>c(H+)>c(Cl-)>c(![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com