
科目: 来源: 题型:
A.该黄铁矿含FeS2也是48% B.硫损失也是2%
C.铁损失也是2% D.该黄铁矿含FeS290%
查看答案和解析>>
科目: 来源: 题型:
A.其主要作用是给催化剂加热
B.其作用是把生成的热量传递给需要预热的混合气体,并将反应后生成的气体冷却
C.为了充分利用预热,使冷水经过热交换器,从而得到热水
D.进行热量传递时,冷、热气体流向相同
查看答案和解析>>
科目: 来源: 题型:
(1)1.00 mol FeS2完全氧化,需要空气的体积(标准状况)为________ L。
(2)55 L空气和足量FeS2完全反应后,气体体积(同温同压)变为________ L。
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100 L,其中O2为a L,SO2为b L。
①写出a和b的关系式。
②在下图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)。
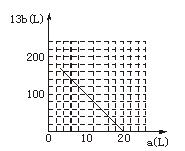
说明:为方便作图,纵坐标用13b表示。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
A.硫磺和硫铁矿均可作为生产原料
B.将矿石粉碎,是为了提高矿石的利用率
C.反应中通入过量的空气是为了提高FeS2和SO2的转化率
D.从吸收塔出来的硫酸经浓缩后可以变成发烟硫酸
查看答案和解析>>
科目: 来源: 题型:
A.碳酸镁 B.硫酸钡 C.氢氧化镁 D.碳酸钡
查看答案和解析>>
科目: 来源: 题型:
(1)得到高纯度的固体烧碱,含杂质NaCl 0.1% 以下,NaClO3极微量,隔膜法产品含上述杂质分别为:0.1%~1.2%和0.1%~0.3%。
(2)得产品浓度:烧碱液(含NaOH 35%~48%;隔膜法产品含NaOH约10%),大大降低用于蒸发浓缩的能量消耗。
(3)要求高浓度的原料食盐水中所含钙、镁等金属离子的总量控制在0.1 ppm以下。
请根据食盐水电解的两极反应和副反应,离子迁移和放电及上述两种膜(交换膜和隔膜)的性能,简单说明离子交换膜电解槽具有上述特点的原因。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com