
科目: 来源: 题型:

(1)单质F是___________________________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)___________________。
(3)溶液I中所含金属离子是_____________________________。
(4)由C![]() E+F,若改用浓酸,则不能选用的浓酸是(写化学式)______________。
E+F,若改用浓酸,则不能选用的浓酸是(写化学式)______________。
查看答案和解析>>
科目: 来源: 题型:
(1)目前常用的镍镉(Ni-Cd)电池,其总电池反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____________(填序号)。
2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是____________(填序号)。
A.以上反应是可逆反应 B.以上反应是不可逆反应
C.充电时化学能转化为电能 D.放电时化学能转化为电能
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使面积为一平方米的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为___________________________________。
(3)另一种常用电池是锂电池,由于它的比容量(单位质量电极材料所能转换的电荷量)特别大而广泛用于心脏起搏器,一般使用时间可长达十年。它的负极用金属锂制成,电池总反应式为:Li+MnO2===LiMnO2。
试回答:锂电池比容量特别大的原因是___________________________________。
锂电池中电解质溶液需用非水溶剂配制,为什么这种电池不能使用电解质的水溶液?试用化学方程式表示其原因____________________________________。
查看答案和解析>>
科目: 来源: 题型:
阳极反应式:2CO+2CO![]() ===4CO2↑+4e-;
===4CO2↑+4e-;
阴极反应式:_________________________________________;
总电池反应式:_______________________________________;
查看答案和解析>>
科目: 来源: 题型:
A.正极反应式:O2+2H2O+4e-===4OH-
B.负极电极反应式:CH3OH+6OH--6e-===CO2+5H2O
C.电池在使用过程中,电解质溶液的pH降低
D.当外电路通过1.2 mol电子时,理论上消耗甲醇6.4 g
查看答案和解析>>
科目: 来源: 题型:
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
又已知铅蓄电池放电时发生如下反应:
正极:PbO2+4H++SO![]() +2e-===PbSO4+2H2O,
+2e-===PbSO4+2H2O,
负极:Pb+SO![]() -2e-===PbSO4。
-2e-===PbSO4。
现拟用铅蓄电池作电源电解饱和食盐水制Cl2 0.05 mol,电池内H2SO4的消耗量至少是
A.0.025 mol B.0.05 mol C.0.10 mol D.0.20 mol
查看答案和解析>>
科目: 来源: 题型:
A.碳棒附近产生OH- B.碳棒上放出氢气
C.碳棒上放出氧气 D.铁棒被腐蚀
查看答案和解析>>
科目: 来源: 题型:
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
查看答案和解析>>
科目: 来源: 题型:
A.正极为Cu,负极为Fe,电解质溶液为FeCl3
B.正极为C,负极为Fe,电解质溶液为Fe(NO3)3
C.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3
D.正极为Ag,负极为Fe,电解质溶液为CuSO4
查看答案和解析>>
科目: 来源: 题型:
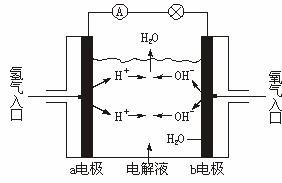
A.a电极是负极
B.b电极的电极反应为:4OH--4e-===2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com