
科目: 来源: 题型:
A.在电流作用下氯化钠在水溶液中电离成钠离子和氯离子
B.氯化钾晶体不能导电,所以它是非电解质
C.硫酸钙微溶于水,但硫酸钙属于强电解质
D.甲、乙两种酸的溶液,甲的导电能力强,则甲是强电解质,乙是弱电解质
查看答案和解析>>
科目: 来源: 题型:
为测定上述(NH4)2SO4和NH4HSO4固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00 mL,加热至120 ℃左右,使氨气全部逸出〔(NH4)2SO4和NH4HSO4的分解温度均高于200 ℃〕,测得有关实验数据如下(标准状况):
实验序号 | 样品的质量/g | NaOH溶液的体积/mL | 氨气的体积/L |
Ⅰ | 7.4 | 40.00 | 1.68 |
Ⅱ | 14.8 | 40.00 | 3.36 |
Ⅲ | 22.2 | 40.00 | 1.12 |
Ⅳ | 37.0 | 40.00 | 0.00 |
(1)实验过程中有关反应的离子方程式为__________________。
(2)由Ⅰ组数据直接推测:标准状况下3.7 g样品进行同样实验时,生成氨气的体积为________L。
(3)试计算该混合物中(NH4)2SO4和NH4HSO4的物质的量之比。
(4)欲计算该NaOH溶液的物质的量浓度应选择第________组数据,由此求得NaOH溶液的物质的量浓度为___________。
查看答案和解析>>
科目: 来源: 题型:

请按要求填空:
(1)写出下列物质的化学式:A.________,E._________,F._________,Y._________。
(2)反应⑤的化学方程式为____________________。
(3)1 mol B通过反应②得到1 mol F,B中F的质量分数为72%,则B的化学式为________。
![]()
查看答案和解析>>
科目: 来源: 题型:

回答下列问题:
(1)X:_____________;A:______________;C:______________。(填化学式)
(2)反应③的离子方程式:_______________;
反应④的离子方程式:_______________。
(3)一种不常见的离子化合物W,与X①反应生成的气体组成元素相同,在受热分解时,生成甲、乙两种单质,且n(甲)∶n(乙)=5∶1,M(甲)<M(乙),则W的化学式为_________,其与盐酸反应的化学方程式为__________________,推测W应具有较强的_________性(填“氧化”或“还原”)。
查看答案和解析>>
科目: 来源: 题型:

(1)若A为浓H2SO4,B为第三周期金属元素组成的片状金属单质,它在常温下难与水反应,C为品红溶液,实验中观察到溶液红色褪去,则B为__________;然后向烧杯中注入沸水,又可观察到的现象是______________________。
(2)若B为块状大理石,C为C6H5ONa溶液,实验中观察到溶液变浑浊,则
①酸A不宜用下列的________。
A.HCl B.HNO3 C.H2SO4 D.CH3COOH
②然后向烧杯中加入沸水,可观察到的现象是_________________________。
(3)若B为生石灰,实验中观察到C溶液先生成沉淀,而后沉淀溶解,当溶液恰好澄清时,关闭F,然后向烧杯中加热水,静止片刻,观察到试管壁上有光亮的银镜,则A是___________,C是___________与乙醛的混合液,仪器D在实验中的作用是____________。
查看答案和解析>>
科目: 来源: 题型:
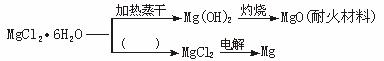
请回答下列问题:
(1)在图中的括号内填写适当的反应条件。
(2)Mg(OH)2固体存在如下溶解平衡:
Mg(OH)2(s)![]() Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
Mg2++2OH-。向体系中加入(至少填两种不同类别的物质)______________,有利于Mg(OH)2溶解。
(3)NaF和MgO的核间距离分别为2.31×10-10 m和2.10×10-10 m,但两者的熔点分别为993 ℃和2852 ℃。试解释其可能的原因。
(4)依据绿色化学的原子经济的概念(即化学反应的原料中每个原子都参与反应并全部转化为产物),203 kg MgCl2·6H2O原料,可以获得28.8 kg MgO、________kg 36.5%的盐酸和________kg MgCl2。
查看答案和解析>>
科目: 来源: 题型:
①将溶液滴在蓝色石蕊试纸上,试纸显红色;
②取溶液少许,加入铜片和稀硫酸共热,产生无色气体,该气体遇到空气立即变为红棕色;
③取溶液少许,加入氨水有白色沉淀生成,继续加入过量氨水,沉淀不消失;
④取溶液少许,滴入氯化钡溶液产生白色沉淀;
⑤取实验④后的澄清溶液,滴入硝酸银溶液产生白色沉淀,再加入过量的稀硝酸,沉淀不消失。
请回答下列问题:
(1)在实验①中,如图所示的操作正确的是___________(填代号)。

(2)根据上述实验判断原溶液中肯定存在的离子是________,肯定不存在的离子是________。
(3)写出与②③④三个实验有关的离子方程式:
②________________________________________________________________________;
③______________________________________________________________________;
④______________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com