
科目: 来源: 题型:
(1)在前2 min内用FeCl2的浓度变化表示的平均反应速率是____________。
(2)在后4 min内用HCl浓度变化表示的平均反应速率是____________。
(3)前2 min与后4 min相比,反应速率__________较快,原因是________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)原料气的平均摩尔质量为____________。
(2)原料气中,N2与H2的体积比为______________。
(3)在合成氨反应中,生成NH3的物质的量是________,平衡时,混合气体中N2和H2的物质的量之比为________。
查看答案和解析>>
科目: 来源: 题型:
压强/Pa | 2×105 | 5×105 | 1×106 |
D的浓度/mol·L-1 | 0.085 | 0.20 | 0.44 |
根据表中数据,完成下列问题:
(1)压强从2×105 Pa增加到5×105 Pa时,平衡向_________(填“正”“逆”)反应方向移动,理由是__________________________。
(2)压强从5×105 Pa增加到1×106 Pa时,平衡向_________(填“正”“逆”)反应方向移动,理由是___________。平衡之所以向该反应方向移动,是由于____________________。
查看答案和解析>>
科目: 来源: 题型:
(1)该化学方程式中各物质的化学计量数为:
a=_________,b=_________,c=_________,d=_________。
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态A._________,B._________,D._________。
(3)若只升高温度,反应一段时间后,测知四种物质的物质的量又达相等,则该反应为_________反应(填“放热”或“吸热”)。
查看答案和解析>>
科目: 来源: 题型:
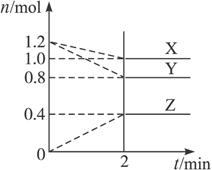
查看答案和解析>>
科目: 来源: 题型:
(1)从理论上看,压强增大,平衡向正反应方向移动,SO2的转化率增大。但工业上二氧化硫催化氧化采用常压而不用高压,主要的原因是____________________________。
(2)保持上述温度和压强不变,若向容器中只充入2 mol SO3,并加入固体催化剂,则平衡时SO2的体积分数是________,此时平衡混合气体的体积是________。
(3)温度仍保持537 ℃,容器的体积保持200 L不变。充入a mol SO2和b mol O2,并加入固体催化剂,反应达到平衡时,SO3的体积分数仍为0.91,体系压强为1.01×105 Pa。若a∶b=2∶1,则a=________。
查看答案和解析>>
科目: 来源: 题型:
A.M>N B.N>M
C.M=N D.无法比较
查看答案和解析>>
科目: 来源: 题型:
A.升高温度时,正反应速率加快,逆反应速率减慢
B.若x=1,容器体积保持不变,新平衡下E的体积分数为50%
C.若x=2,容器体积保持不变,新平衡下F的平衡浓度为0.5a mol·L-1
D.若x=2,容器压强保持不变,新平衡下E的物质的量为a mol
查看答案和解析>>
科目: 来源: 题型:
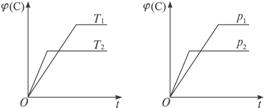

A.达到平衡后,若使用催化剂,C的体积分数将增大
B.达到平衡后,若温度升高,化学平衡向逆反应方向移动
C.化学方程式中,化学计量数的关系为n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目: 来源: 题型:
A.升温 B.加压
C.通入过量氧气 D.降温
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com