
科目: 来源: 题型:
物质 | 分子式 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水中的溶解性 |
甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
据此,将甲和乙分离的最佳方法是( )
A.萃取法 B.升华法 C.蒸馏法 D.分液法
查看答案和解析>>
科目: 来源: 题型:
6![]() +10Al+18H2O
+10Al+18H2O![]() 3N2↑+10Al(OH)3+6OH-
3N2↑+10Al(OH)3+6OH-
某化学兴趣小组的同学经过探究发现还有两条途径:
(1)金属镁比铝能更快消除氮的污染,其反应原理和金属铝相同。金属镁是由海水中提取的MgCl2通过电解制得的。若要除去1 m3废水中0.3 mol的![]() ,则至少需要含0.5%(质量分数)MgCl2的海水多少千克?
,则至少需要含0.5%(质量分数)MgCl2的海水多少千克?
(2)将甲醇加入含![]() 的废水中也可消除氮的污染,它可在一种微生物作用下发生反应:
的废水中也可消除氮的污染,它可在一种微生物作用下发生反应:
6![]() +6H++5CH3OH
+6H++5CH3OH![]() 3N2↑+5CO2↑+13H2O
3N2↑+5CO2↑+13H2O
若某废水用上述方法处理时,![]()
![]() N2的转化率为a%,那么每天处理此含
N2的转化率为a%,那么每天处理此含![]() 为b g·L-1的废水V m3(密度1 g·cm-3),需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
为b g·L-1的废水V m3(密度1 g·cm-3),需要甲醇多少千克?(要求写出解题步骤,运算过程中的数据及最后结果只需写出运算式,不必化简)
查看答案和解析>>
科目: 来源: 题型:
设某具有30万户人口的中等城市,每户每天燃煤5 kg,这种煤中含FeS2 5%,燃烧时,设有90%的硫转化成二氧化硫,被排放到大气中。FeS2燃烧时化学方程式如下:
4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
问:(1)燃烧1 t煤,可产生多少千克的SO2?
(2)该中等城市如果全部以上述的煤作燃料,每年(按365天计算)将有多少吨SO2排放到大气中?
查看答案和解析>>
科目: 来源: 题型:
(1)应先向废水中加入 溶液,离子方程式为 。
(2)然后再向废水中加入 溶液,离子方程式为 。
查看答案和解析>>
科目: 来源: 题型:
(1)据测算,接触法制硫酸过程中,若反应热都未被利用,则每生产1 t 98%的硫酸需消耗3.6×105 kJ的热量。请通过计算判断,若反应SO2(g)+![]() O2(g)
O2(g)![]() SO3;ΔH=-98.3 kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
SO3;ΔH=-98.3 kJ·mol-1放出的热量能在生产过程中得到充分利用,则每生产1 t 98%的硫酸只需外界提供(或可向外界输出)多少千焦热量?(H2SO4的摩尔质量为98 g·mol-1)
(2)CuFeS2是黄铁矿的另一成分,燃烧时,CuFeS2转化为CuO、Fe2O3和SO2,该反应的化学方程式为 。
(3)硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度的不同而变化(见下表)。
沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
矿渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
已知CuSO4在低于660 ℃时不会分解,请简要分析上表中CuSO4的质量分数随温度升高而降低的原因 。
查看答案和解析>>
科目: 来源: 题型:
2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-98.3 kJ·mol-1
2SO3(g);ΔH=-98.3 kJ·mol-1
N2(g)+3H2(g)![]() 2NH3(g);ΔH=-46.2 kJ·mol-1
2NH3(g);ΔH=-46.2 kJ·mol-1
根据勒夏特列原理,加热均不利于产物的生成。试分析工业上为什么均采用加热到500 ℃的高温。
查看答案和解析>>
科目: 来源: 题型:
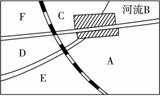
(1)请在图中A、B、C、D、E、F处选一最佳建厂处,说明理由。
(2)请你预测此工厂将有哪些方面对环境造成污染?
(3)请你用物理、化学、生物等方面的知识设计一个保护环境、控制污染的方案。
查看答案和解析>>
科目: 来源: 题型:
A.FeCl3溶液 B.AlCl3溶液 C.Na2S溶液 D.AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
A.1 L该溶液中含溶质98 g
B.从10 mL该溶液中取出5 mL后,剩余溶液浓度仍为1 mol·L-1
C.将4.9 g浓硫酸加入盛有50 mL蒸馏水的烧杯中,充分混合就可配得该浓度的硫酸溶液
D.该浓度的硫酸具有酸的通性,但不具有强氧化性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com