
科目: 来源: 题型:
(1)直流电源已输出_____________ mol电子。
(2)溶液中c(Cu2+)=____________mol·L-1。
查看答案和解析>>
科目: 来源: 题型:
A.0.5 mol·L-1 B.1.0 mol·L-1
C.1.5 mol·L-1 D.2.0 mol·L-1
查看答案和解析>>
科目: 来源: 题型:
(1)若两极均为铜片,试说明电解过程中浓度将怎样变化:__________________________。
(2)若阴极为纯锌,阳极为铜片,阳极反应式是_________________________。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重_______g,阴极上的电极反应式是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
A.粗铜板作阳极
B.电解时,阳极发生氧化反应,而阴极发生的反应为:Cu2++2e-====Cu
C.粗铜中所含Ni、Fe、Zn等金属杂质,电解后以单质形式沉积槽底,形成阳极泥
D.电解铜的纯度可达99.95%—99.98%
查看答案和解析>>
科目: 来源: 题型:
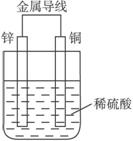
图4-10
A.铜是阳极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片 D.氢离子在铜片表面被还原
查看答案和解析>>
科目: 来源: 题型:
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-====Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-====![]() +4H2O
+4H2O
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目: 来源: 题型:
Zn(s)+2MnO2+H2O(l)====Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2+H2O(l)+2e-====Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减小了6.5 g
查看答案和解析>>
科目: 来源: 题型:
(1)两极发生的电极反应式为:阴极:______________;阳极:__________________。
(2)写出![]() 变为Cr3+的离子方程式:__________________________。
变为Cr3+的离子方程式:__________________________。
(3)工业废水由酸性变为碱性的原因是:___________________________。
(4)_________(填“能”或“不能”)改用石墨电极,原因是______________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
时间/min气体体积/L | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
阴极生成的气体 | 6 | 12 | 20 | 29 | 39 | 49 | 59 | 69 |
阳极生成的气体 | 2 | 4 | 7 | 11 | 17 | 23 | 28 | 34 |
(1)完成有关的电极反应式:阴极__________;阳极____________;
(2)完成电解的总化学方程式_______________________________;
(3)开始电解阶段两极产生气体的体积比不符合理论比值的原因是______________________;
(4)自第__________分钟起阴极与阳极产生气体的体积比约为理论的比值;
(5)该过程NaOH溶液的pH如何变化__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com