
科目: 来源: 题型:
A.NaOH B.NH3·H2O
C.AgNO3 D.BaCl2
查看答案和解析>>
科目: 来源: 题型:
①加热时放出的气体可以使品红溶液褪色;
②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;
③加入氯水时,溶液略显黄色,再加入BaCl2溶液,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在原溶液中是否存在的是( )
A.Br- B.![]() C.H2SO3 D.
C.H2SO3 D.![]()
查看答案和解析>>
科目: 来源: 题型:
(1)F-能还原Fe3+,使之转变为Fe2+;
(2)F-能与Fe3+结合生成难电离的物质;
(3)F-能与SCN-反应,消耗了加入溶液中的SCN-。
以上三种解释,你认为错误的是___________。理由是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
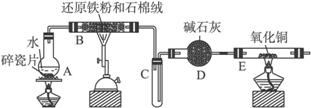
图6-22
(图中夹持及尾气处理装置均已略去)
(1)装置B中发生反应的化学方程式是_______________________________________。
(2)装置E中的现象是_____________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:______________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]() FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是_______________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:_____________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)____________________。
查看答案和解析>>
科目: 来源: 题型:
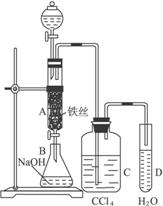
图6-21
(1)写出A中反应的化学方程式______________________________________。
(2)观察到A中的现象是___________________________。
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是_____________,写出有关的化学方程式__________________________。
(4)C中盛放CCl4的作用是____________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入______________,现象是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
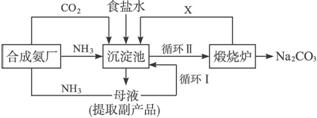

图6-20
(1)上述生产纯碱的方法称_____________,副产品的一种用途为_____________。
(2)沉淀池中发生的化学反应方程式是_____________。
(3)写出上述流程中X物质的化学式_____________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了_____________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是_____________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_____________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有_____________。
a.增大![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目: 来源: 题型:
(1)要证明Na2SO3具有还原性,应选用的试剂有____________,看到的现象是____________,反应的离子方程式有____________;
(2)要证明Na2SO3具有氧化性,应选用的试剂有____________,看到的现象是____________,反应的离子方程式有____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com