
科目: 来源: 题型:
(1)甲厂的废水明显呈碱性,故甲厂的废水中所含的三种离子是:_________________。
(2)乙厂的废水含有另外三种离子,如果加一定量___________(选填:活性炭、FeSO4、铁粉),可以回收其中的金属_______________(填符号)。
另一种设想是将甲、乙两厂的废水按适当的比例混合,可以使废水中的_________________(填离子符号)转化为沉淀。经过滤后的废水主要含___________________,可用来浇灌农田。
查看答案和解析>>
科目: 来源: 题型:
(1)若无固体粉末剩余,则溶液中阳离子一定有______________,可能还有____________。
(2)若剩余固体粉末为![]() W g,则溶液中的阳离子一定有____________,可能还有____________,一定没有_________________。
W g,则溶液中的阳离子一定有____________,可能还有____________,一定没有_________________。
(3)若剩余固体粉末为![]() W g,则在溶液中阳离子一定有______________,一定没有_____________。
W g,则在溶液中阳离子一定有______________,一定没有_____________。
查看答案和解析>>
科目: 来源: 题型:
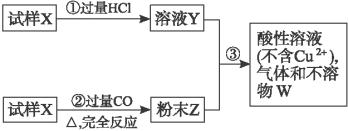
(1)请写出步骤③中所发生的全部反应的离子方程式:
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成不溶物W的质量是m,则每份试样X中氧化铜的质量为_________________。
查看答案和解析>>
科目: 来源: 题型:
A.Fe B.Cu C.Pb D.Zn
查看答案和解析>>
科目: 来源: 题型:
工业上制氯化铜时,是将浓盐酸用蒸气加热至80 ℃左右,慢慢加入粗制氧化铜粉(含杂质氧化亚铁),充分搅拌使之溶解,反应如下:CuO+2HCl====CuCl2+H2O,
FeO+2HCl====FeCl2+H2O。已知:pH≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3—4时,Fe3+以Fe(OH)3的形式完全沉淀。
(1)为除去溶液中的Fe2+,可以采用的方法是( )
A.直接加碱,调整溶液pH≥9.6
B.加纯铜粉,将Fe2+还原出来
C.先将Fe2+氧化成Fe3+,再调整pH在3—4之间
D.通入硫化氢,使Fe2+直接沉淀
(2)工业上为除去溶液中的Fe2+,常使用NaClO,当向溶液中加入NaClO后,溶液pH变化情况是( )
A.肯定减小 B.肯定增大 C.可能减小 D.可能增大
(3)若此溶液中只含有Fe3+时,要调整pH在3—4之间,此时最好向溶液中加入( )
A.NaOH溶液 B.氨水 C.CuCl2溶液 D.CuO固体
查看答案和解析>>
科目: 来源: 题型:
战后玻尔从溶液中提取金,又重新铸成了奖章,下列方法中,你认为不能从溶有黄金的王水中提取金的是( )
A.用铁置换
B.电解其水溶液
C.先蒸发水分后灼烧固体
D.过滤
查看答案和解析>>
科目: 来源: 题型:
A.(Ⅰ)用① B.(Ⅱ)用② C.(Ⅲ)用③ D.(Ⅳ)用④
查看答案和解析>>
科目: 来源: 题型:
①空气 ②二氧化碳 ③氩气 ④氢气 ⑤氮气 ⑥水
A.①② B.③④ C.③⑥ D.③⑤
查看答案和解析>>
科目: 来源: 题型:
A.是银白色质软的金属 B.氢氧化铊是两性氢氧化物
C.能生成+3价的化合物 D.能置换出盐酸中的氢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com