
科目: 来源: 题型:
①1体积N2和足量H2反应,必定生成2体积NH3
②其他条件不变,增大压强,平衡必定向右移动
③平衡时,H2消耗速率必定等于N2生成速率的3倍
④平衡时,H2的浓度必定等于N2浓度的3倍
A.①② B.③④ C.①④ D.②③
查看答案和解析>>
科目: 来源: 题型:
①用物质A表示的反应的平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol·L-1
A.①③ B.①④ C.②③ D.③④
查看答案和解析>>
科目: 来源: 题型:
(1)A的化学式(分子式)是_____________________________。
(2)B燃烧生成C和D的化学方程式是___________________________________________。甲元素的单质与F溶液反应的离子方程式是________________________________________。
(3)往G溶液中加入NaOH溶液发生的现象是______________________________________。
查看答案和解析>>
科目: 来源: 题型:
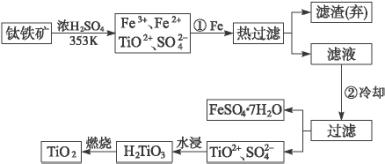
(1)Ti的原子序数为22,Ti位于元素周期表中第_____________周期,第____________族。
(2)步骤①加Fe的目的是:__________________________________________;步骤②冷却的目的是:___________________________________________________________。
(3)上述制备TiO2的过程中,可以利用的副产物是___________________;考虑成本和废物综合利用因素,废液中应加入________________________处理。
(4)由金红石(TiO2)制取单质Ti,涉及的步骤为:
TiO2→TiCl4![]() Ti
Ti
反应TiCl4+2Mg====2MgCl2+Ti在氩气中进行的理由是_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

请按要求回答:
(1)写出B的化学式______________,G的电子式______________________。
(2)反应①的离子方程式为________________________________________。
(3)反应②进行的条件是__________________________,________________________。
(4)反应③的化学方程式为_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
①将5%Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2—3遍;
②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50—80 ℃之间至铁屑耗尽;
③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;
④待结晶完毕后,滤出晶体,用少量冰水洗涤2—3次,再用滤纸将晶体吸干;
⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)实验步骤①的目的是_____________________________________________,加热的作用是_____________________________________________________________。
(2)实验步骤②明显不合理,理由是__________________________________________。
(3)实验步骤④中用少量冰水洗涤晶体,其目的是________________________________________________________________。
(4)经查阅资料后发现,硫酸亚铁在不同温度下结晶可分别得到FeSO4·7H2O、FeSO4·4H2O和FeSO4·H2O。硫酸亚铁在不同温度下的溶解度和该温度下析出晶体的组成如下表所示(仅在56.7 ℃、64 ℃温度下可同时析出两种晶体)。
酸硫亚铁的溶解度和析出晶体的组成
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 |
溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | |||||||
请根据表中数据作出硫酸亚铁的溶解度曲线。
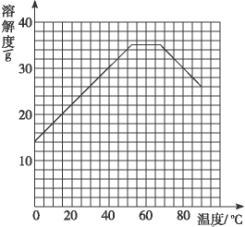
(5)若需从硫酸亚铁溶液中结晶出FeSO4·4H2O,应控制的结晶温度(t)的范围为_________________________。
查看答案和解析>>
科目: 来源: 题型:
(Fe2O3),反应原理是:2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑
某研究性学习小组用下图所示装置分别检验该反应所产生的气态物质,然后利用装置A瓶内的生成物来测定已分解的FeSO4的质量。(已知:SO2沸点为-10.02 ℃)
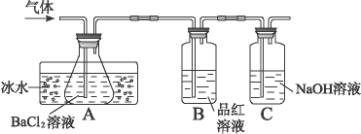
请回答相关问题:
(1)本实验中,A瓶所盛BaCl2溶液可以吸收的气体是_______________,发生反应的离子方程式为_________________________________________________________。
(2)B瓶所盛试剂的作用是______________________________________;C瓶所盛试剂的作用是___________________________________________________________。
(3)A瓶要用冷水冷却的原因是______________________________________________。
(4)某学生欲利用装置B反应前后的质量差确定已分解的FeSO4质量,你认为该同学方案是否合理______(填“合理”“不合理”),理由是______________________________________。
(5)依据上述装置和反应事实,请设计测定已分解的FeSO4质量的操作和方法:_______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
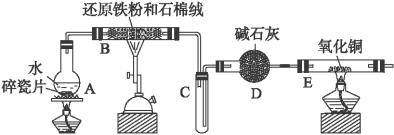
(1)装置B中发生反应的化学方程式是_________________________________________。
(2)装置E中的现象是_________________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:_______________________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
滤液![]() FeCl3溶液
FeCl3溶液![]() FeCl3·6H2O晶体
FeCl3·6H2O晶体
①步骤Ⅰ中通入Cl2的作用是____________________________________________。
②步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________________________________________________________。
③该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)______________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.Mg、AlCl3、NaAlO2
B.KNO3、NaCl、CH3COONa
C.NaClO、Na2SO3、BaCl2
D.Ba(NO3)2、FeSO4、NH4HCO3
查看答案和解析>>
科目: 来源: 题型:
A.a=b B.a=2b C.2a=b D.a=5b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com