
科目: 来源: 题型:
A.甲烷是一种非极性分子 B.甲烷分子具有正四面体结构
C.甲烷分子具有极性键 D.甲烷分子中H—C—H的键角为90°
查看答案和解析>>
科目: 来源: 题型:
下列说法正确的是( )
A.因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐
B.CO2通入水玻璃(Na2SiO3溶液)可以得到原硅酸
C.因为高温时SiO2与Na2CO3反应生成CO2,故硅酸的酸性比碳酸强
D.SiO2的俗名叫水晶
查看答案和解析>>
科目: 来源: 题型:
某硫酸厂周围的空气含有较多二氧化硫,为了测定空气中二氧化硫的体积分数做了如下实验:
取上述标准状况下的空气
(1)通入足量溴水的目的是:____________________。
(2)加入过量BaCl2溶液的目的是:____________________。
(3)过滤后,若在滤液中加K2SO4溶液,有白色沉淀产生,证明:____________________。
(4)用蒸馏水洗涤沉淀2~3次,若在洗液中加入AgNO3溶液,无沉淀出现,证明:____________________。
(5)空气中,SO2的体积分数为__________。
查看答案和解析>>
科目: 来源: 题型:
(提示:Si+2NaOH+H2O![]() Na2SiO3+2H2↑)
Na2SiO3+2H2↑)
查看答案和解析>>
科目: 来源: 题型:

(1)丙的名称是________;C的化学式是________。
(2)A+D→C的反应属于下列何种反应类型(填序号)________。
A.化合反应 B.氧化还原反应
C.非氧化还原反应 D.离子反应
(3)工业生产中,将D转化为E的反应条件是___________________。
(4)写出A与H2O反应的化学方程式:___________________。
(5)若用如下图所示装置来证明A和H2O的反应:
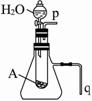
①是放热反应,②生成了丙。简单合理的实验操作是:
①____________________;
②____________________。
查看答案和解析>>
科目: 来源: 题型:
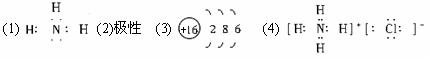
(1)元素n的气态氢化物的电子式为________。
(2)m与y所形成的化合物含________键。
(3)x的原子结构示意简图为________。
(4)由n、y的氢化物相互作用所生成的物质的电子式为。
查看答案和解析>>
科目: 来源: 题型:
H2O2+2Fe2++2H+![]() 2Fe3++2H2O
2Fe3++2H2O
H2O2+2Fe3+![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
H2O2的电子式为______,在以上反应中Fe2+实际上起着______作用,总反应方程式为____________。
(2)I2也与Fe2+一样发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:
H2O2+I2![]() 2HIO,______,总反应式为______。
2HIO,______,总反应式为______。
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液变棕黄色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为H2O2+2I-![]() I2+O2↑+2H+,这个方程式正确吗?;若不正确,原因是(若认为正确,以下必作答)______,并写出正确的化学反应方程式(若是离子反应,写出离子反应式):______。
I2+O2↑+2H+,这个方程式正确吗?;若不正确,原因是(若认为正确,以下必作答)______,并写出正确的化学反应方程式(若是离子反应,写出离子反应式):______。
(4)若将H2O2滴入酸性KMnO4溶液中,产生无色气体同时溶液的紫色变浅,无沉淀生成,写出反应的离子方程式____________。
查看答案和解析>>
科目: 来源: 题型:
(1)浓硫酸在此反应中表现出的性质是______;试管底部的白色固体是______(填化学式)。
(2)写出铜片变黑的化学方程式:__________________。
查看答案和解析>>
科目: 来源: 题型:

(1)判断A可能是______(分子式,下同),B是______,C是______,D是______。
(2)D和B反应的离子方程式__________________。
(3)A和B反应的化学方程式__________________,离子方程式____________。
查看答案和解析>>
科目: 来源: 题型:
(1)写出下列元素的符号:B______,D______,E______。
(2)五种元素中,原子半径最大的是______,常温下能与水剧烈反应的单质的元素是______,气态氢化物最稳定的是____________(用A、B、C、D、E、F回答)。
(3)A、C两种元素最高价氧化物对应的水化物反应的离子方程式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com