
科目: 来源: 题型:
 所示,其中:
所示,其中:(1)某电中性粒子一般不和其他元素的原子发生反应,这种粒子符号是____________。
(2)某粒子的盐溶液,加入AgNO3溶液时会出现白色沉淀,这种粒子的符号是____________。
(3)某粒子氧化性很弱,但得到1个电子后还原性很强,这种粒子的符号是____________。
(4)某粒子具有很强的还原性,且这种粒子失去2个电子即变为原子,这种粒子的符号是____________。
查看答案和解析>>
科目: 来源: 题型:
A.m(A-N)/A mol B.m(A-N+2)/A mol
C.(A-N+2)/A m mol D.m(A-N-2)/A mol
查看答案和解析>>
科目: 来源: 题型:


(1)上述生产纯碱的方法称___________,副产品的一种用途为______________________。
(2)沉淀池中发生的化学反应方程式是_______________________________________。
(3)写出上述流程中X物质的分子式___________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了___________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是___________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加_______________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用有___________。
a.增大![]() 的浓度,使NH4Cl更多地析出
的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
查看答案和解析>>
科目: 来源: 题型:
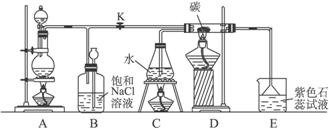
(1)A为氯气发生装置,写出反应的化学方程式:____________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃C处和D处的酒精灯,连上E装置。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(g),试写出D装置中反应的化学方程式_________________;装置C的作用是_________________。
(3)E处石蕊试液的现象是_________________,其原因是_________________。
(4)若将E处溶液改为石灰水,反应过程的现象是____________。
a.有白色沉淀生成
b.无白色沉淀生成
c.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是_________________,B的作用是_________________。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

试完成下列问题:
(1)烧瓶A中发生反应的化学方程式为①_________________,②MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(2)气体通过容器B的目的是_______________________,气体通过容器C的目的是_____________________________。
(3)石英玻璃管D中发生反应的化学方程式是__________________________________。
(4)球形干燥管E中碱石灰的作用是:_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)把气球b中碳酸钙粉末小心地倒入瓶中,立即产生许多气泡,气球逐渐胀大(图Ⅱ)。反应结束后,再次称量,质量为W2。则W1和W2的关系是___________。

(2)取25 mL 6 mol·L-1NaOH溶液,先用滴管取少量NaOH溶液,滴管插入胶管c口(为方便操作,可以适当倾斜瓶a,注意防止漏气)。打开d,将溶液挤入瓶中,立即夹紧d,可以看到瓶内产生少量白色沉淀,轻轻摇动瓶a,沉淀随即消失。用同样方法再加入少量NaOH溶液,又产生白色沉淀,轻摇,沉淀又消失。使沉淀消失的反应的化学方程式是_______________________________________。
(3)将全部NaOH溶液很快加入瓶中,夹紧d,瓶内产生大量白色沉淀,不再溶解,此时瓶内温度___________(填“不变”“降低”或“升高”)。
(4)继续轻摇瓶a,气球逐渐缩小,直至恢复反应前的下垂状。写出这时发生的反应的化学方程式:____________________________;____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com