
科目: 来源: 题型:
(1)欲计算得Li+和I-的近似半径,你还必须做何假设?
(2)计算Li+、I-的近似半径。
(3)若用另一种方法测得Li+的半径为6.0×10-11~6.8×10-11 m,试验证你的假设是否正确。
查看答案和解析>>
科目: 来源: 题型:
A.Cs+配位数为6,S2-配位数为6
B.Cs+配位数为6,S2-配位数为3
C.Cs+配位数为8,S2-配位数为8
D.Cs+配位数为4,S2-配位数为8
查看答案和解析>>
科目: 来源: 题型:
离子 | Be2+ | Mg2+ | ?La3+? | K+ | F- |
离子半径/pm | 31 | 65 | 104 | 133 | 136 |
下列各离子晶体中阳离子配位数与氯化钠中钠离子配位数相同的是( )
A.LaF3 B.MgF2 C.BeF2 D.KF
查看答案和解析>>
科目: 来源: 题型:

试回答下列问题:
(1)在NaCl晶体中,每个Na+同时吸引个________Cl-,而Na+数目与Cl-数目之比为__________。
(2)Na+半径与Cl-半径之比![]() =__________。(已知
=__________。(已知![]() =1.414,
=1.414,![]() =1.732,
=1.732,![]() =2.236)
=2.236)
(3)NaCl晶体不存在分子,但在温度达到1 413 ℃时,NaCl晶体形成气体,并以分子形式存在,现有29.25 g NaCl晶体,强热使温度达到1 450 ℃,测得气体体积为5.6 L(已折算为标准状况),则此时氯化钠气体的分子式(化学式)为__________。
查看答案和解析>>
科目: 来源: 题型:
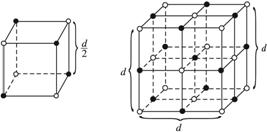
晶体具有规则的几何外形,晶体中最基本的重复单元称为晶胞。NaCl晶体结构如上图所示。已知FexO晶体晶胞结构为NaCl型,由于晶体缺陷,x值小于1。测知FexO晶体密度为ρ=5.71 g·cm-3,晶胞边长为4.28×10-10m。
(1)FexO中x值(精确至0.01)为__________。
(2)晶体中的Fen+分别为Fe2+、Fe3+,在Fe2+和Fe3+的总数中,Fe2+所占分数(用小数表示,精确至0.001)为__________。
(3)此晶体化学式为____________________。
(4)与某个Fe2+(或Fe3+)距离最近且等距离的O2-围成的空间几何形状是__________。
(5)在晶体中,铁元素的离子间最短距离为__________m。
查看答案和解析>>
科目: 来源: 题型:
物质 ①NaF ②NaI ③MgO
离子电荷数 1 1 2
键长/10-10m 2.31 3.18 2.10
A.①>②>③ B.③>①>②
C.③>②>① D.②>①>③
查看答案和解析>>
科目: 来源: 题型:
A.离子化合物中一定不含共价键
B.共价化合物中一定不含离子键
C.两种元素组成的化合物中一定不含非极性键
D.由于水分子之间存在氢键,所以水分子比较稳定
查看答案和解析>>
科目: 来源: 题型:
A.离子键没有方向性和饱和性,而共价键有方向性和饱和性
B.两种不同的非金属元素可以形成离子化合物
C.配位键在形成时,是由成键双方各提供一个电子形成共用电子对
D.金属键的实质是金属中的“自由电子”与金属阳离子形成的一种强烈的相互作用
查看答案和解析>>
科目: 来源: 题型:
A.带相反电荷离子之间的相互吸引称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属元素形成的化合物中不可能含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com