
科目: 来源: 题型:

A.A是Zn,B是Cu,C为稀H2SO4
B.A是Cu,B是Zn,C为稀H2SO4
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液
查看答案和解析>>
科目: 来源: 题型:
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2在负极发生氧化反应
查看答案和解析>>
科目: 来源: 题型:
下列叙述,正确的是( )
A.在放电过程中,电池负极区溶液pH减小
B.在放电过程中,电极负极区pH增大
C.在放电过程中,电子由Ag2O经外电路流向Zn
D.放电时,Ag2O电极发生氧化反应,Zn极发生还原反应
查看答案和解析>>
科目: 来源: 题型:

(1)铁片与铜片不用导线连接,有何现象发生?写出反应的化学方程式。
(2)用导线把金属片连接起来,现象有什么不同?用最恰当的化学方程式表示发生的反应。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
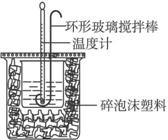
中和热的测定
(1)烧杯间填满碎泡沫塑料的作用是_______________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值_____________。(填“偏大”“偏小”或“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量_____________(填“相等”“不相等”),所求中和热_____________(填“相等”“不相等”),简述理由:____________________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会_____________(填“偏大”“偏小”“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
A.KOH(aq)+![]() H2SO4(aq)
H2SO4(aq)![]()
![]() K2SO4(aq)+H2O(l) ΔH=-11.46 kJ·mol-1
K2SO4(aq)+H2O(l) ΔH=-11.46 kJ·mol-1
B.2KOH(aq)+H2SO4(aq) ![]() K2SO4(aq)+2H2O(l)ΔH=-114.6 kJ·mol-1
K2SO4(aq)+2H2O(l)ΔH=-114.6 kJ·mol-1
C.2KOH(aq)+H2SO4(aq) ![]() K2SO4(aq)+2H2O(l) ΔH=+114.6 kJ·mol-1
K2SO4(aq)+2H2O(l) ΔH=+114.6 kJ·mol-1
D.KOH(aq)+![]() H2SO4(aq)
H2SO4(aq)![]()
![]() K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
ΔH=-393.51 kJ·mol-1
C(金刚石)+O2(g)![]() CO2(g) ΔH=-395.41 kJ·mol-1
CO2(g) ΔH=-395.41 kJ·mol-1
据此判断,下列说法中正确的是 ( )
A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com