
科目: 来源: 题型:

(1)A点沉淀物的化学式为____________;B点沉淀物的化学式为___________。
(2)原混合物中的MgCl2的物质的量为___________,AlCl3的物质的量为___________,NaOH的物质的量为___________。
(3)HCl溶液在Q点的加入量是___________。
查看答案和解析>>
科目: 来源: 题型:
A.1∶1 B.2∶
查看答案和解析>>
科目: 来源: 题型:阅读理解
铝可以从铝土矿中获取。铝土矿是不纯净的铝的氧化物(杂质为Fe2O3和SiO2),它是非再生资源。假如对铝的消费保持现有的速度,获得生产足够的铝所需的铝土矿仅能维持30年左右。由此看来,保护现有自然资源和对非再生资源的再利用,是值得考虑的。但废物回收有相当大的难度,其关键因素主要涉及旧金属的收集,与其他废物的分离、回收和提炼金属的费用,金属本身的价值等。(已知1 mol电子电量约为
(1)试说明回收铝的过程中存在的困难。
(2)为什么金的回收率比铝的回收率要大得多?
(3)常温下,SiO2与强碱或强酸是很难反应的。现利用盐酸、氢氧化钠溶液、氨气、二氧化碳和水,从铝土矿中提取纯净的Al2O3。试设计一个适用于工业Al2O3的实验方案。用化学方程式表示提纯的过程。
(4)制取1 mol Al需要多少库仑的电量?
(5)假定用6 V直流电源供电进行电解,制2.7 t Al需要多少千焦的电能?(请列式并计算)
查看答案和解析>>
科目: 来源: 题型:
![]() +5I-+6H+
+5I-+6H+![]() 3I2+3H2O
3I2+3H2O
I2+![]()
![]() 2I-+
2I-+![]()
查看答案和解析>>
科目: 来源: 题型:
2KMnO4+16HCl![]() 2KCl+2MnCl2+5Cl2↑+8H2O
2KCl+2MnCl2+5Cl2↑+8H2O
(1)
(2)若Cl2在标准状况下的密度为
查看答案和解析>>
科目: 来源: 题型:
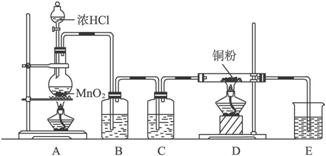
(1)实验室里,实验前检查整套装置的气密性方法是:_____________________________。
(2)装置A中发生的化学反应方程式为_____________________________。
(3)装置B的广口瓶盛__________,其作用是_____________________________________。装置C的广口瓶盛__________,其作用是___________________。装置E的烧杯中盛有__________,其作用是_____________________________。
(4)待充分反应后,装置D的玻璃管中剩余物呈_________色,冷却后,将制得的产物配成饱和溶液,溶液呈_________色。
查看答案和解析>>
科目: 来源: 题型:
(1)使用ClO2作饮用水消毒剂的优点是_____________________________。
(2)目前国外多用NaClO3与浓HCl反应制取ClO2,同时有Cl2生成,且体积为ClO2的一半,写出反应的化学方程式。__________________________________________________
(3)上述反应中产生0.1 mol Cl2,转移的电子的物质的量为_________ mol。
(4)在H2SO4酸性条件下,用Na2SO3还原NaClO3可制得ClO2,反应为:2NaClO3+Na2SO3 +H2SO4![]() 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
这种方法的优点是________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com