
科目: 来源: 题型:
A.SO2能使FeCl3、KMnO4水溶液迅速褪色
B.可以用澄清石灰水鉴别SO2和CO2
C.硫粉在过量的纯氧中燃烧可以生成SO3
D.少量SO2通过浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
科目: 来源: 题型:
A.小于0.45 mol B.等于0.45 mol
C.在0.45 mol与0.90 mol之间 D.大于0.90 mol
查看答案和解析>>
科目: 来源: 题型:
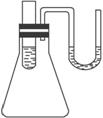
A.小试管内液体分成两层,上层蓝色,下层无色
B.U形细管内左边液面下降,右边液面升高
C.小试管中有少量固体析出
D.以上现象都没有,无明显变化
查看答案和解析>>
科目: 来源: 题型:
A.常温下,浓H2SO4与铁、铝不反应,所以铁质、铝质容器可盛放浓H2SO4
B.浓硫酸具有吸水性,能使蔗糖炭化
C.浓硫酸和铜片加热既表现强酸性,又表现出强氧化性
D.浓硫酸与亚硫酸钠反应制取二氧化硫时,浓H2SO4表现出强氧化性
查看答案和解析>>
科目: 来源: 题型:
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红溶液褪色 ④通入足量的NaOH溶液中再滴加BaCl2溶液有白色沉淀生成,该沉淀能溶于盐酸 ⑤通入溴水中能使溴水褪色,再加Ba(NO3)2溶液有白色沉淀
A.都能证明 B.都不能证明
C.③④⑤能证明 D.只有⑤能证明
查看答案和解析>>
科目: 来源: 题型:
A.将SO2通入Ba(OH)2溶液中,有白色沉淀生成,加过量稀硝酸沉淀消失,得到无色溶液
B.将SO2通入硝酸酸化的BaCl2溶液中,有白色沉淀生成,加稀盐酸后沉淀不消失
C.将SO2通入BaCl2溶液,有白色沉淀生成,加稀盐酸后沉淀消失
D.将SO2通入Ba(OH)2溶液中,有白色沉淀生成,加过量稀盐酸后沉淀消失
查看答案和解析>>
科目: 来源: 题型:
(1)最初加入的50 mL NaOH溶液的作用是什么?
答:_________________________________________________________________。
(2)计算所用硫酸的浓度。
(3)试判断两种氧化物各是什么,并计算其物质的量。
查看答案和解析>>
科目: 来源: 题型:
(1)将孔雀石、石青分别加盐酸至完全溶解,耗用盐酸的物质的量与产生CO2的物质的量之比为:孔雀石4∶1,石青3∶1,则它们的化学组成为:孔雀石___________,石青___________。
(2)今有一份碳酸盐类铜矿样品,将其分成A、B两份,然后加盐酸使A样品完全溶解,产生CO2
(3)某碳酸盐类铜矿完全溶解后,产生CO2
(4)设某碳酸盐类铜矿样品的质量为A g,所含CuO的质量为G g,加酸完全溶解后,产生CO2的体积为V L(标准状况),则所含铜矿样品A、V、C的关系式为___________。
查看答案和解析>>
科目: 来源: 题型:

图1 图2
填写下列空白:
(1)实验进行时试管A中应加入的试剂是_________;烧瓶B的作用是______________________;烧瓶C的作用是__________________;在试管D中收集得到的是______________________。
(2)实验时,U形管G中应加入的试剂是___________;长颈漏斗H中应加入___________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母) ___________。
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是__________________________。
(5)试管E中发生反应的化学方程式是______________________________________________。
(6)为了安全,在E管中的反应发生前,在F出口处必须___________;E管中的反应开始后,在F出口处应___________。
查看答案和解析>>
科目: 来源: 题型:

(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为___________ (用m表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com