
科目: 来源: 题型:
A.该灰黑色粉末用作抗氧化剂?
B.该灰黑色粉末不可食用?
C.小袋中原来装有铁粉?
D.小袋中原来装有氧化铁
查看答案和解析>>
科目: 来源: 题型:
A.Cl2不但能与金属活动顺序表氢以前的金属反应,也能与金属活动顺序表氢以后的金属反应
B.N2是大气中的主要成分之一,雷雨时,可直接转化为NO2?
C.硫是一种淡黄色的能溶于水的晶体,既有氧化性又有还原性?
D.硅是应用广泛的半导体材料,常温下只与氟气、氢氟酸反应
查看答案和解析>>
科目: 来源: 题型:
(1)写出Cu2O跟稀硝酸反应的化学反应方程式__________________。?
(2)产物中硝酸铜的物质的量____________mol。?
(3)如混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量分别是__________mol、____________mol。?
(4)如混合物中Cu的物质的量为![]() ,求其中Cu2O、CuO的物质的量及
,求其中Cu2O、CuO的物质的量及![]() 的取值范围__________、____________、___________。
的取值范围__________、____________、___________。
查看答案和解析>>
科目: 来源: 题型:
 ?
?
(1)写出化学式:单质B___________,化合物F___________。?
(2)写出下列反应的离子反应方程式:③_________,⑤__________。?
(3)反应④的化学反应方程式为____________。
?
查看答案和解析>>
科目: 来源: 题型:
①光导纤维的主要成分是_____________。?
②目前应用最多的太阳能电池的光电转化材料是________________。?
(2)氮化硅Si3N4是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取。粉末状Si3N4对空气和水都不稳定。但将粉末状的Si3N4和适量氧化镁在230×1.01×105 Pa和
①写出由SiCl4和NH3反应制取Si3N4的化学反应方程式________________。?
②Si3N4和适量氧化镁在230×1.01×105 Pa和
查看答案和解析>>
科目: 来源: 题型:
(1)钒被认为是一种稀土元素,广泛存在于各种矿物中。钾钒铀矿中的钒原子最外层已达8电子稳定结构,其化学式为K2H6U2V2O15,若用氧化物的形式表示,该化合物的化学式为________________。?
(2)测定钒含量的方法是先把钒转化成V2O5,V2O5?在酸性溶液里转变成![]() ,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:?
,再用盐酸、硫酸亚铁、草酸等测定钒。总反应可表示为:?
![]() (未配平)?
(未配平)?
其中还原剂是______________。若消耗
查看答案和解析>>
科目: 来源: 题型:
①供选择的实验装置:?
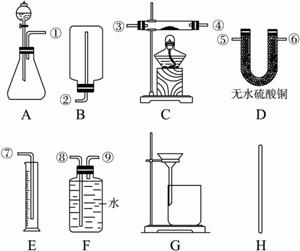 ?
?
②实验中可测得的数据:黄铜的质量![]() g,充分反应后生成的标准状况下的H2体积少
g,充分反应后生成的标准状况下的H2体积少![]() L;反应前仪器药品的质量
L;反应前仪器药品的质量![]() g,充分反应后剩余固体的质量
g,充分反应后剩余固体的质量![]() g;充分反应后仪器和药品的质量
g;充分反应后仪器和药品的质量![]() g。?
g。?
请在下表中完成三个实验小组的三种不同方案和计算式:
| 选用药品的名称 | 选用的实验装置序号 | 组装时接口编号的连接顺序(如不需要组装,则不填) | 需测得的实验数据(从上述可测得的数据中选取) | 合金中锌的质量分数的计算式 |
方案一 | 稀硫酸 | AFE |
|
|
|
方案二 |
|
|
|
|
|
方案三 |
|
|
|
|
|
查看答案和解析>>
科目: 来源: 题型:
A.8∶5 B.4∶5? C.1∶1 D.5∶8
查看答案和解析>>
科目: 来源: 题型:
A.0.1mol·L-1? B.0.2 mol·L-1??
C.0.4 mol·L-1?? D.0.8 mol·L-1?
查看答案和解析>>
科目: 来源: 题型:
A.澄清石灰水?
B.氢氧化钠溶液?
C.溴化钠溶液?
D.饱和碳酸钠溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com