
科目: 来源: 题型:
某市质检局对某市场中的某个品牌的奶粉,取
查看答案和解析>>
科目: 来源: 题型:
请完成下列问题:
(1)已知M的分子量为227,由C、H、O、N等四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是_____________________。D是双原子分子,分子量为30,则D的分子式为_____________。
(2)油脂A经下列途径可得到M。

图中②的提示:![]()
反应①的化学方程式是_________________________________________________。
反应②的化学方程式是_________________________________________________。
(3)若将0.1mol B与足量的金属钠反应,则需消耗____________g金属钠。
查看答案和解析>>
科目: 来源: 题型:
(1)乳酸可发生下列变化:
![]()
各步反应所用的试剂:①_____________________②_______________________。
(2)乳酸可以与精制铁粉制备一种药物,反应化学方程式是:
_________________________________________________________________。
该反应中氧化剂是:_____________还原产物是: ______________。
(3)若碳原子以单键与4个不同的原子或原子团相结合,则该碳原子被称为“手性碳原子”,含手性碳原子的分子称为“手性分子”,手性分子往往具有一定的生物活性。
乳酸分子是 手性分子,其中的手性碳原子是____________号碳原子。
手性分子,其中的手性碳原子是____________号碳原子。
查看答案和解析>>
科目: 来源: 题型:
(1)写出葡萄糖转化为乳酸的化学方程式:________________________________________。
(2)取
(3)乙醇在铜或者银的催化作用下,可以发生反应:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,乳酸在铜或者银的催化作用下,可以发生类似的反应,且产物为
2CH3CHO+2H2O,乳酸在铜或者银的催化作用下,可以发生类似的反应,且产物为![]() 。请推断乳酸的结构简式:_____________。
。请推断乳酸的结构简式:_____________。
(4)写出化学方程式:
①钠与乳酸的反应:__________________________________________________。
②乳酸与乙酸的酯化反应:______________________________________________。
查看答案和解析>>
科目: 来源: 题型:

①向圆底烧瓶中加入几粒碎瓷片,先后注入15 mL(0.14 mol)异戊醇和20 mL(0.35 mol)冰醋酸,最后小心加入5 mL浓H2SO4,振荡使其不再分层。
②在烧瓶上安装水冷凝管,连好上、下水,后加热装置1 h冷却至室温。
③把烧瓶内混合液倒入盛有饱和Na2CO3溶液的锥形瓶中,振荡后静置。
④把③中水层分离出后,再用蒸馏水洗涤有机层几次,并将洗涤后水层分离出。
⑤将分离的有机层转移到另一锥形瓶中,加入无水MgSO4或Mg(NO3)2处理。最后将处理后的有机层经135—
试完成以下问题:
(1)写出乙酸和异戊醇合成乙酸异戊酯的化学方程式________________________________,其中浓H2SO4的作用是____________________________________,烧瓶内碎瓷片的作用是_______________________________。
(2)水冷凝器的作用是_____________,冷凝管的a口是冷却水的_____________(填“进口”“出口”)。
(3)乙酸和异戊醇物质的量之比0.35∶0.14大于1∶1,其原因是_____________。
(4)③中饱和碳酸钠的作用是_____________;⑤中无水MgSO4或Mg(NO3)2的作用是_____________。
(5)步骤③的操作应用_____________(填仪器名称),洗涤分离出水层后,应怎样把有机层转移至锥形瓶里_____________。
查看答案和解析>>
科目: 来源: 题型:
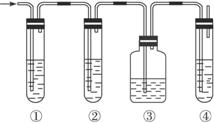
A.品红溶液 B.NaOH溶液 C.浓H2SO4 D.高锰酸钾酸性溶液
试完成下列问题:
(1)图中①、②、③、④装置可盛放的试剂是①________________,②_________________,③_________________,④_________________。(将上列有关试剂的序号填入空格内)。
(2)能说明SO2存在的现象是________________________________________________。
(3)使用装置②的目的是_____________________________________。
(4)使用装置③的目的是_____________________________________。
(5)确证乙烯存在的现象是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
A.98 B
查看答案和解析>>
科目: 来源: 题型:
A.聚四氟乙烯分子中含有双键 B.聚四氟乙烯的单体是不饱和烃
C.聚四氟乙烯中氟的质量分数是76% D.聚四氟乙烯的化学活性较强
查看答案和解析>>
科目: 来源: 题型:
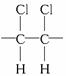 ,下列说法正确的是( )
,下列说法正确的是( )A.聚合物的结构单元为
B.聚合物的分子式为C3H3Cl3
C.聚合物的单体(对应的小分子)为CHCl=CHCl
D.若n表示结构单元重复的次数,则其相对分子质量为97n
查看答案和解析>>
科目: 来源: 题型:
A.两种气体进入量都减少 B.增大空气进入量或减少液化气进入量
C.两种气体进入量都增大 D.减小空气进入量或增大液化气进入量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com