
科目: 来源: 题型:
(1)Na3N的电子式_________________,该化合物是由_________________键形成。
(2)Na3N与水反应的方程式为___________________,该反应属__________________(填基本反应类型)反应。
(3)Na3N放入足量盐酸中生成_________________种盐,其化学式为____________________。
(4)比较Na3N中两种粒子的半径:r(Na+)_________________r(N3-)。(填“>”“=”或“<”)
查看答案和解析>>
科目: 来源: 题型:
(1)A—E的元素符号为:________、_______、________、________、_________。
(2)C位于元素周期表中第______周期、第_______族,其阳离子的结构示意图为_____________。
(3)D原子的电子式为_________________;E离子的符号为_________________。
(4)A元素与其余4种元素形成化合物的化学式为(仅限于由两种元素组成)____________、___________、____________、_____________。
(5)C单质和B单质在加热条件下生成A2B2反应的化学方程式_____________________,反应中为_________氧化剂;_________为还原剂。
(6)
查看答案和解析>>
科目: 来源: 题型:
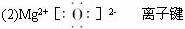
有关反应的化学计量关系为:
①A与B按物质的量之比n(A)/n(B)=1/2完全反应生成G
②B与C按物质的量之比n(B)/n(C)=3/1完全反应生成F
③C与D按物质的量之比n(C)/n(D)=1/3完全反应生成E
请填空:
(1)构成上述物质各元素的离子中,电子层结构相同且按其离子半径由大到小排列的顺序是(用离子符号表示) _________________。
(2)物质G的电子式是_________________,其化学键类型是_________________。
(3)B和C反应生成F的化学方程式为_____________________________________________。
(4)实验室中制取E的化学方程式为___________________________________________,
干燥E时常用干燥剂的名称是______________________________________________。
(5)常温下将F投入J中可生成E和一种白色难溶物X,该反应的化学方程式为_____________;若将I通入J中可生成H和某物质Y,X与Y溶液可发生中和反应,该反应的离子方程式为____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
(1)元素C位于第_______周期第_______族,它的最高价氧化物的化学式为_________________。
(2)A元素是_____________,B元素是_______________,D元素是________________。
(3)A与D形成稳定化合物的化学式是_________________,判断该化合物在空气中是否变质的简单方法是_______________________________。
(4)C元素的单质有毒,可用A的最高价氧化物对应的水化物的溶液吸收,其离子方程式为
_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:

①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②用_________________量取10.00 mL 1 mol·L-1盐酸和醋酸溶液分别加入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为_____________;
④在广口瓶中装足量的水,按上图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录
__________________________________________________________________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应______________________________________________,读出量筒中水的体积为V mL。
请将上述步骤补充完整并完成下列问题:
(1)用文字表述④检查装置气密性的操作与观察方法:_______________________________。
(2)本实验中应选用_________________ (填序号)的量筒。
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:
Vm=_________________。
(4)上述速率不等的原因是___________________________________________________,
铜丝不与酸接触的原因是___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
试完成下列问题:
(提示:氢氧化钙的溶解度随温度升高而降低)

(1)实验中观察到的现象___________________________________________________。
(2)产生上述现象的原因是__________________________________________________。
(3)写出有关反应的离子方程式_______________________________________________。
(4)由实验推知,MgCl2溶液和H2的总能量_________________ (填“大于”“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目: 来源: 题型:
能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需依靠其他能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取:2H2O(l)![]() 2H2(g)+O2(g)。已知2 mol H2O(l)所具有的总能量低于2 mol H2(g)与1 mol O2(g)所具有的总能量。
2H2(g)+O2(g)。已知2 mol H2O(l)所具有的总能量低于2 mol H2(g)与1 mol O2(g)所具有的总能量。
(1)对于制取H2的反应下列说法中不正确的是( )
A.该反应是氧化还原反应 B.该反应是分解反应
C.该反应是放热反应 D.该反应是吸热反应
(2)下列叙述正确的是( )
A.电能是二级能源 B.水力是二级能源
C.天然气是一级能源 D.水煤气、干馏煤气是一级能源
(3)关于用水制取二级能源氢气,以下研究方向不正确的是( )
A.构成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢气成为二级能源
B.设法将太阳光聚集,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水在分解产生氢气的同时释放能量
D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
查看答案和解析>>
科目: 来源: 题型:
A.一定是共价键 B.一定是离子键
C.可能是共价键,也可能是离子键 D.以上说法均不正确
查看答案和解析>>
科目: 来源: 题型:

A.X+Y![]() 2Z;0.05 mol·(L·min)-1
2Z;0.05 mol·(L·min)-1
B.X+Y![]() 2Z;0.1 mol·(L·min)-1
2Z;0.1 mol·(L·min)-1
C.X+2Y![]() Z;0.1 mol·(L·min)-1
Z;0.1 mol·(L·min)-1
D.X+3Y![]() 2Z;0.05 mol·(L·min)-1
2Z;0.05 mol·(L·min)-1
查看答案和解析>>
科目: 来源: 题型:
A.使用催化剂能改变反应速率 B.降低压强能加快反应速率
C.升高温度能加快反应速率 D.改变压强对反应速率无影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com